控制适合的条件,将反应2Fe3++2I- 2Fe2++I2设计成右图所示的原电池。下列判断不正确的是( )
2Fe2++I2设计成右图所示的原电池。下列判断不正确的是( )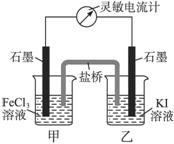
| A.反应开始时,乙中石墨电极上发生氧化反应 |
| B.反应开始时,甲中石墨电极上Fe3+被还原 |
| C.电流计读数为零时,反应达到化学平衡状态 |
| D.电流计读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极 |
某烯烃与H2加成后的产物是 , 则其结构式可能有
, 则其结构式可能有
| A.1种 | B.2种 | C.3种 | D.4种 |
下列说法不正确的是
①、CH3—CH=CH2和CH2=CH2的最简式相同②、 CH≡CH和C6H6含碳量相同
③、丁二烯和丁烯为同系物④、正戊烷、异戊烷、新戊烷的沸点逐渐变低
⑤、标准状况下,11.2L的庚烷所含的分子数为0.5 NA(NA为阿伏加德罗常数)
⑥、能够快速、微量、精确的测定相对分子质量的物理方法是核磁共振谱法
| A.①和⑤ | B.②和③ | C.③⑤和⑥ | D.④和⑥ |
进行一氯取代后,只生成三种沸点不同的产物的烷烃是
| A.(CH3)2CHCH2CH2CH3 | B.(CH3CH2)2CHCH3 |
| C.(CH3)2CHCH(CH3)2 | D.(CH3)3CCH2CH3 |
下列有机物名称正确的是
| A.2-乙基戊烷 | B.1,2-二氯丁烷 |
| C.2,2-二甲基-4-己醇 | D.3,4-二甲基戊烷 |
下列属于分离、提纯固态有机物的操作的是
| A.蒸馏 | B.萃取 | C.重结晶 | D.分液 |