向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g) SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如下所示。由图可得出的正确结论是
SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如下所示。由图可得出的正确结论是
| A.反应在c点达到平衡状态 |
| B.反应物浓度:a点小于b点 |
| C.反应物的总能量低于生成物的总能量 |
| D.△t1=△t2时,SO2的转化率:a~b段小于b~c段 |
已知化学反应A2(g) + B2(g) ="==" 2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )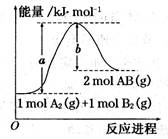
A.每生成2分子AB吸收bkJ热量
B. 该反应热△H=+(a-b)kJ/mol
C. 该反应中反应物的总能量高于生成物的总能量
D. 断裂1molA—A和1molB—B键,放出akJ能量
下列有关化学方程式的叙述正确的是( )
A.已知2H2(g) + O2(g) ="==" 2H2O(g)△H=-483.6kJ/mol, 则氢气的燃烧热为241.8 kJ/mol
B. 已知C(石墨, s) ="==" C(金刚石,s)△H>0,则金刚石比石墨稳定
C. 含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(aq)+ HCl(aq) ="==" NaCl(aq) + H2O(l)△H="-57.4kJ/mol"
D.已知2C(s)+2O2(g) ===2CO2(g)△H12C(s)+ O2(g) ===2CO(g)△H2则△H1>△H2
在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系。下列条件关于离子共存说法中正确的是()
| A.a点对应的溶液中大量存在:Fe3+、Na+、Cl-、SO42 |
| B.b点对应的溶液中大量存在:NH4+、Ba2+、OH-、I- |
| C.c点对应的溶液中大量存在:Na+、Ba2+、Cl-、HCO3- |
| D.d点对应的溶液中大量存在:Na+、K+、SO32-、Cl— |
E是非金属性最强的元素,M是E的气态氢化物,在固定体积的密闭容器中,气体M存在如下关系:xM(g) Mx (g),反应物和生成物的物质的量随时间的变化关系如下图。下列说法正确的是
Mx (g),反应物和生成物的物质的量随时间的变化关系如下图。下列说法正确的是
A.该反应的化学方程式是2HF (HF)2 (HF)2 |
| B.平衡时混合气体的平均摩尔质量是33.3 |
C.t1时刻,保持温度不变,再充入1molM,重新达到平衡时,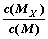 将增大 将增大 |
| D.M的沸点比同主族下一周期元素的气态氢化物沸点低 |
某温度下,水的离子积常数K 。该温度下,将pH=4的
。该温度下,将pH=4的 溶液与pH=9的NaOH溶液混合并保持恒温,欲使混合溶液的pH=7,则稀硫酸与NaOH溶液的体积比为( )
溶液与pH=9的NaOH溶液混合并保持恒温,欲使混合溶液的pH=7,则稀硫酸与NaOH溶液的体积比为( )
| A.1∶10 | B.9∶1 | C.1∶9 | D.99∶21 |