关于原子轨道的说法正确的是
| A.凡是中心原子采取sp3杂化轨道成键的分子其立体构型都是正四面体形 |
| B.CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合起来而形成的 |
| C.sp3杂化轨道是由同一个原子中能量相近的s轨道和p轨道混合起来形成的一组能量相近的新轨道 |
| D.凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键 |
甲醇燃料电池可用于笔记本电脑等,它一极通入氧气,另一极通入甲醇;电解质能传导H+。电池工作时, 2CH3OH+3O2 = 2CO2+4H2O ,下列说法正确的是
| A.通甲醇一极为正极。 |
| B.正极电极反应式 3O2 + 12H+ + 12e- = 6H2O |
| C.电池工作时电子从氧气一极流向甲醇一极。 |
| D.当转移24mol e-时,消耗的甲醇2mol。 |
在一定体积的密闭容器中放入3L气体R和5L气体Q,在一定条件下发生反应2R(g) + 5Q(g) ="=" 4X(g) + nY(g)反应完全后,容器温度不变,混合气体的压强是原来的87.5%,则化学方程式中的n值是
| A.2 | B.3 | C.4 | D.5 |
在一可变容积的密闭容器中进行反应:C(s) + H2O(g)=" CO(g)" + H2(g),下列条件能使反应速率增大的是
| A.增加C的量 |
| B.将容器的体积缩小一半 |
| C.保持体积不变,充入N2,使体系的压强增大 |
| D.保持压强不变,充入N2,使容器的体积变大 |
铅蓄电池的工作原理为Pb+PbO2+2H2SO4===2PbSO4+2H2O,研读下图,下列判断不正确的是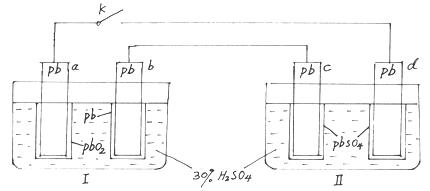
| A.K闭合时,d电极反应式:PbSO4+2H2O-2e-===PbO2+4H++SO42- |
| B.当电路中转移0.2 mol电子时,Ⅰ中消耗的H2SO4为0.2 mol |
| C.K闭合时,Ⅱ中SO42-向c电极迁移 |
| D.K闭合一段时间后,Ⅱ可单独作为原电池,d电极为正极 |
铜锌原电池(如图)工作时,下列叙述正确的是
| A.正极反应为:Zn-2e-===Zn2+ |
| B.电池反应为:Zn+Cu2+===Zn2++Cu |
| C.在外电路中,电子从正极流向负极 |
| D.盐桥中的K+移向ZnSO4溶液 |