如图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1 mol·L-1,工作一段时间后,测得导线中均通过0.01mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中不正确的是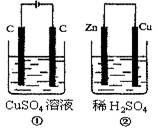
| A.右边电极上生成物质的物质的量:①=② |
| B.相同状态下电极上产生气体的体积:①=② |
| C.溶液的pH变化:①减小,②增大 |
| D.电极反应式①中阴极Cu2++2e-=Cu:②中负极:Zn-2e-=Zn2+ |
某化学兴趣小组,专门研究了氧族元素及其某些化合物的部分性质。查得的资料如下:
①常温下,硒(Se)和碲(Te)为固体,H2Se和H2Te为气体
②Te和H2不能直接化合生成H2Te;
③氧气、硫、硒、碲与1 mol H2反应的焓变(△H)情况如下表所示。
| 物质 |
O2 |
S |
Se |
Te |
| △H(kJ·mol-1) |
-242 |
-20 |
81 |
请回答下列问题:
(1)写出氧族元素中含有18个电子的两种氢化物的化学式、。
(2)写出硒化氢发生分解反应的热化学方程式:。
(3)已知H。Te分解反应的△S>0,△H="-154" kJ·mol-1,请解释Te和H2不能直接化
合的原因:。
(4)H2S的水溶液显弱酸性,写出其电离方程式:;它的第一级电离常数可用Kai来表示,当温度升高时,Kai的值(填“一定增大”、“一定减小”或“不能确定”)。
(5)在容积均为1 L(容器体积不可变)的甲、乙两个容器中,分别充人2mol SO2、1 mol O2和4 mol SO2、2 mol O2,在相同条件下使其反应。最终达到平衡后,甲、乙两容器中SO2转化率分别为50%和a(乙),则反应的平衡常数KC=L·mol-1(填写具体数据),此时a(乙)50%(填“大于”、“小于”或“等于”)。
下图为中学化学中几种常见物质之间的转化关系。
已知:
①A、C、D是常见的气体单质;
②F气体极易溶于水,且液态常用做制冷剂;
③G为易溶性的盐,E为白色沉淀;
④H为无色液体化合物。
(1)写出D的原子结构示意图。
(2)鉴定G中阳离子的实验方法和现象
。
(3)反应②的离子方程式。
(4)反应③的化学方程式。
(5)将等物质的量的F与G溶于水,所得溶液pH>7,则该溶液中各种离子浓度大小顺序为。
下图为从反面琴到的某套实验装置示意图,无法看到实验说明,加热装置已经省略。
甲同学认为此套装置用于合成物质X,E处冰水冷却的U形管中有固体X(X溶于水得到中学化学常见强酸)出现;乙同学认为此套装置用于合成物质Y,E处冰水冷却的U形管中才有红棕色气体Y生成,并且越接近U形管底部颜色越浅。对于A处,甲认为有加热装置,乙认为没有。
(1)事实上此装置所附实验说明符合甲同学的推断,那么X的化学式是 ,C装置中盛放的液体药品是 。其作用是
。
(2)若要用上述装置完成乙同学所认为的实验,C处所起作用与合成X时所起作用相似,那么C处的广口瓶应改为 ,所装药品为 。
(3)写出乙同学认为的D装置中发生反应的化学方程式 ;为什么此时U形管中的红棕色气体越接近管底颜色越浅? 。
将17.9 g Al、Fe、Cu组成的合金溶于足量的NaOH溶液中,产生气体3.36 L(标准状况)。另取等质量的合金溶于过量的稀硝酸中,生成6.72 L NO(标准状况),向反应后的溶液中加人过量的NaOH溶液,得到沉淀的质量为()
| A.33.2 g | B.25.4 g | C.22.4 g | D.19.6 g |
西维因是一种高效低毒杀虫剂,在碱性条件下可水解:
有关说法正确的是()
| A.西维因分子式为C12H10NO2 |
| B.反应后的溶液经酸化,可用FeCl3溶液检验西维因是否已经发生水解 |
| C.1 mol西维因最多能与6 mol氢气发生加成反应 |
| D.西维因分子中至少有21个原子共平面 |