下列实验能达到目的的是
| 序号 |
实验目的 |
实验操作 |
| A |
证明Ksp(AgI)<Ksp(AgCl) |
在AgNO3溶液中滴加少量NaCl溶液,产生白色沉淀,继续滴加少量KI溶液又产生黄色沉淀 |
| B |
阿司匹林的提纯,即除去混有的水杨酸聚合物等杂质 |
将阿司匹林粗品溶解在适量饱和碳酸氢钠溶液中,抽滤后在滤液中加入盐酸,再抽滤并洗涤 |
| C |
检验火柴头中含氯元素 |
往浸过火柴头的溶液中加AgNO3溶液和稀硝酸 |
| D |
加快锌与稀硫酸反应制取H2的速率 |
在稀硫酸中滴加少量Cu(NO3)2溶液 |
用3 g块状大理石与30 mL 3 mol·L-1盐酸反应制取CO2气体,若要增大反应速率,不可采取的措施是( )
| A.再加入30 mL 3 mol·L-1盐酸 |
| B.改用30 mL 6 mol·L-1盐酸 |
| C.改用3 g粉末状大理石 |
| D.适当升高温度 |
下列事实能说明影响化学反应速率的决定性因素是反应物本身性质的是( )
| A.Cu能与浓硝酸反应,而不与浓盐酸反应 |
| B.Cu与浓硝酸反应比与稀硝酸反应快 |
| C.N2与O2在常温、常压下不反应,放电时可反应 |
| D.Cu与浓硫酸反应,而不与稀硫酸反应 |
下列说法不正确的是( )
| A.反应物分子(或离子)间的每次碰撞是反应的先决条件 |
| B.反应物的分子的每次碰撞都能发生化学反应 |
| C.活化分子具有比普通分子更高的能量 |
| D.活化能是活化分子的平均能量与普通反应物分子平均能量之差,如图所示正反应的活化能为E-E1 |

在容积为2 L的密闭容器中充入2 mol SO2和一定量O2,发生反应2SO2+O2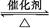 2SO3,当反应进行到4 min时,测得n(SO2)="0.4" mol。若反应进行到2 min末时,容器中SO2的物质的量是( )
2SO3,当反应进行到4 min时,测得n(SO2)="0.4" mol。若反应进行到2 min末时,容器中SO2的物质的量是( )
| A.等于1.6 mol | B.等于1.2 mol | C.大于1.6 mol | D.小于1.2 mol |
在可逆反应2A(g)+3B(g) xC(g)+D(g)中,已知:反应开始加入的物质只有A、B,起始浓度A为5 mol·L-1,B为3 mol·L-1,前2 min C的平均反应速率为0.5 mol·L-1·min-1。2 min后,测得D的浓度为0.5 mol·L-1。则关于此反应的下列说法中正确的是( )
xC(g)+D(g)中,已知:反应开始加入的物质只有A、B,起始浓度A为5 mol·L-1,B为3 mol·L-1,前2 min C的平均反应速率为0.5 mol·L-1·min-1。2 min后,测得D的浓度为0.5 mol·L-1。则关于此反应的下列说法中正确的是( )
A.2 min末时A和B的浓度之比为5∶3
B.x=1
C.2 min末时B的浓度为1.5 mol·L-1
D.2 min末时A的消耗浓度为0.5 mol·L-1