下列方程式的书写或描述正确的是
| A.等质量的硫蒸气和硫固体分别在氧气中完全燃烧,后者放出的热量多 |
B.热化学方程式C2H2(g)+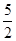 O2(g) O2(g) |
| C.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式为: 2H2(g)+O2(g)=2H2O(l)ΔH= -285.8kJ·mol-1 |
| D.稀溶液中:H+(aq)+OH—(aq)=H2O(l)ΔH=" —53.7kJ/mol" ,若将含0.5 molH2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量大于53.7kJ |
向15mL 0.1mol·L-1KOH溶液中逐滴加入0.2 mol·L-1甲酸(HCOOH,一元弱酸)溶液,溶液pH和加入的甲酸的体积关系曲线如右图所示,有关粒子浓度大小关系正确
A.在A、B间任意一点c(K+) > c(HCOO-) > c(OH-) > c(H+)
B.在B点:c(K+) = c(HCOO-) > c(OH-) = c(H+),且a=7.5
C.在C点:c(HCOO-) > c(K+) > c(OH-) > c(H+)
D.在D点:c(HCOO-) + c(HCOOH) > 2c(K+)
有一种酸式盐AHB,它的水溶液呈弱碱性。则以下说法:①相同物质的量浓度的AOH溶液和H2B溶液,前者的电离程度大于后者的电离程度;②H2B不是强酸;③HB-的电离程度大于HB-的水解程度;④该盐溶液的电离方程式一般写成:AHB=A++HB-,HB-=H++B2-其中错误的是:
| A.①② | B.③④ | C.②③ | D.①④ |
下列叙述中,正确的是:
| A.pH=3和pH=4的盐酸各10mL混合,所得溶液的pH=3.5 |
| B.溶液中c(H+)越大,pH值也越大,溶液的酸性就越强 |
| C.液氯虽然不导电,但溶于水后导电情况良好,因此,液氯也是电解质 |
| D.当温度不变时,在纯水中加入强碱不会影响水的离子积常数 |
对于可逆反应2AB3(g)  A2(g) + 3B2(g) ΔH>0,下列图像正确的是:
A2(g) + 3B2(g) ΔH>0,下列图像正确的是:
在容积相等的两个密闭容器A和B中,保持温度为423K,同时向A、B中分别加入a mol和b mol HI(a > b),发生反应2HI(g)  H2(g)+I2(g)达到平衡后,下列说法中,正确的是:
H2(g)+I2(g)达到平衡后,下列说法中,正确的是:
A.从开始反应到达平衡,所需时间tA>tB
B.平衡时,I2蒸气在混合气体中的体积分数φA>φB
C.平衡时,I2蒸气的物质的量浓度[I2]A=[I2]B
D.HI的平衡转化率,αA=αB