(10分)实验室常用下图中A~E装置制取和收集气体。
(1)写出B图中标有①的仪器名称 。
(2)甲同学用氯酸钾和二氧化锰反应制取氧气,应选择的发生装置是 ,(写字母,下同)收集装置是 。
(3)乙同学认为B装置可用于双氧水和二氧化锰混合制取氧气,其反应的化学方程式为 ,其中二氧化锰起 作用。
(4)丙同学用右图所示装置作制取二氧化碳的发生装置。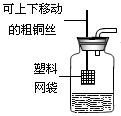
该装置的优点是 。
可以选择哪一种金属材质的网袋替代塑料网袋(从银、铜、铁中选择)?简要说明选择的理由。
(1)磁铁矿的主要成分是:;(填化学式)
(2)写出CO与Fe2O3在高温条件下反应的化学方程式:;
(3)高炉炼铁得到的主要产品是;(填序号)
| A. |
纯铁 |
B. |
生铁 |
C. |
钢 |
(4)铁生锈的主要条件是铁与水和直接接触。
甲、乙两种固体的溶解度曲线如右图所示。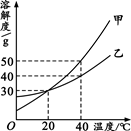
(1)℃时,甲和乙的溶解度相等;
(2)40℃时,若将40g乙(不含结晶水)放入160g水中充分溶解,所得溶液的溶质质量分数为,该溶液是溶液(填"饱和"或"不饱和");
(3)40℃时,将甲、乙两物质的饱和溶液各100g降温至20℃,析出晶体(均不含结晶水)的质量关系是: m(甲)m(乙) (填"﹥"、"﹦"或"﹤")。
右图是某锌锰干电池的剖面图。
(1)锌锰干电池工作时可以将化学能转化为能;
(2)碳棒具有性,可作为干电池的电极;
(3)
可作为实验室用双氧水制
的;
(4)废旧电池中的锌可回收利用,用于实验室与稀硫酸反应制取氢气。写出该反应的化学方程式:。
用符合下列要求的物质的序号填空,可选物质:
| A. |
蛋白质 |
B. |
天然气 |
C. |
氢气 |
D. |
干冰 |
E. |
维生素 |
F. |
生石灰 |
(1)"西气东输"的"气"是:;
(2)可用于人工降雨的是:;
(3)牛奶中的主要营养物质是:;
(4)溶于水时显著放热的是:。
(1)用化学符号表示:
①2个氢原子: ②3个铝离子:
(2)构成物质的微粒有:A.原子;B.分子;C.离子。试判断构成下列物质的微粒,并用相应的序号填空。
①氧气:②铁:③氯化钠: