在一个固定体积的密闭容器中,加入2mol A和1mol B发生反应: ,达到平衡时,C的物质的量百分含量为w,若维持容器体积和温度不变,按下列四种方法改变起始物质,达到平衡后,C的物质的量百分含量大于w的是
,达到平衡时,C的物质的量百分含量为w,若维持容器体积和温度不变,按下列四种方法改变起始物质,达到平衡后,C的物质的量百分含量大于w的是
A. |
B. |
C.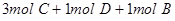 |
D.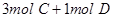 |
如右图所示,在一U型管中装入含有紫色石蕊的Na2SO4试液,通直流电,一段时间后U型管内会形成一个倒立的三色 “彩虹”,从右到左颜色的次序是
| A.蓝、紫、红 | B.红、蓝、紫 |
| C.红、紫、蓝 | D.紫、红、蓝 |
下列反应中生成物总能量高于反应物总能量的是
| A.碳酸钙受热分解 | B.乙醇燃烧 |
| C.铝粉与氧化铁粉末反应 | D.氧化钙溶于水 |
某化合物6.4 g在氧气中完全燃烧,只生成8.8 g CO2和7.2 g H2O。下列说法正确的是
| A.该化合物仅含碳、氢两种元素 | B.该化合物中碳、氢原子个数比为1:2 |
| C.无法确定该化合物是否含有氧元素 | D.该化合物中一定含有氧元素 |
验证淀粉水解可生成还原性糖,进行了下列实验,该实验中操作步骤的排列顺序正确的是 ①取少量淀粉加水制成溶液②加热③加入新制Cu(OH)2悬浊液④加入几滴稀H2SO4⑤加入碱液,中和并呈碱性
| A.①⑤②④③② | B.⑤④②③①② | C.①④②⑤③② | D.①②③④⑤② |
下列每组各有三种物质,它们都不能用分液漏斗分离的是:
| A.乙酸乙酯和水,酒精和水,苯和水; | B.二溴乙烷和水、溴苯和水、乙醛和水 |
| C.硝基苯和苯、甲苯和苯、乙酸和乙醇; | D.甘油和水、油脂和水,已烷和汽油 |