在一定温度下,反应2HBr(g) 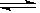 H2(g)+Br2(g) ΔH>0,达到平衡时,要使混合气体颜色加深,可采取的方法是( )
H2(g)+Br2(g) ΔH>0,达到平衡时,要使混合气体颜色加深,可采取的方法是( )
| A.减小压强 | B.缩小体积 | C.降低温度 | D.增大氢气的浓度 |
下列各组有机物只用一种试剂无法鉴别的是(必要时可以加热)
| A.乙醇、甲苯、硝基苯 | B.苯、苯酚、己烯 |
| C.苯、甲苯、环己烷 | D.甲酸、乙醛、乙酸 |
下列化工生产过程所发生的反应不属于氧化还原反应的是
| A.用氯气和消石灰制漂白粉 | B.皂化反应 |
| C.用铝土矿(有效成分是氧化铝)制金属铝 | D.氯碱工业 |
下列各组物质按酸、碱、盐分类次序排列正确的是
| A.硫酸、纯碱、苏打 | B.高锰酸、烧碱、生石灰 |
| C.原硅酸、石英、石膏 | D.氢氟酸、熟石灰、明矾 |
下列事实或性质与胶体没有直接关系的是
| A.同一钢笔使用不同牌号的墨水容易堵塞 | B.在河流入海处易形成三角洲 |
| C.向NaOH溶液中滴加FeCl3溶液产生沉淀 | D.水稻田使用NH4NO3的肥效较差 |
在强酸性溶液中能大量共存,并且溶液为无色透明的离子组是
| A.K+、Na+、HCO3—、Cl— | B.NH4+、Al3+、SO42—、NO3— |
| C.K+、NH4+、MnO4—、SO42— | D.Na+、OH—、SO42—、ClO- |