在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
| 物质 |
X |
Y |
Z |
| 初始浓度/mol·L-1 |
0.1 |
0.2 |
0 |
| 平衡浓度/mol·L-1 |
0.05 |
0.05 |
0.1 |
下列说法错误的是:( )
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
实验是化学研究的基础,关于下列各实验装置图的叙述中,正确的是: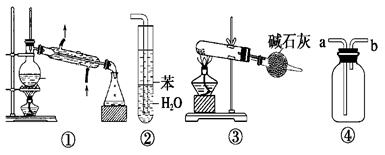
| A.装置①常用于分离沸点不同的液体混合物 |
| B.装置②用于吸收氨气,能够防止倒吸 |
| C.以NH4Cl为原料,装置③可制备少量NH3 |
| D.装置④a口进气可收集Cl2、NO等气 |
在检验SO42-的过程中,下列操作中正确的是:
| A.先加入稀硝酸,没有产生沉淀,然后再加硝酸钡,产生白色沉淀,证明有SO42-存在 |
| B.先加入硝酸钡,产生白色沉淀,然后再加稀硝酸,沉淀不溶解,证明有SO42-存在 |
| C.先加入稀盐酸,没有产生沉淀,然后再加氯化钡,产生白色沉淀,证明有SO42-存在 |
| D.先加入氯化钡,产生白色沉淀,然后再加稀盐酸,沉淀不溶解,证明有SO42-存在 |
最近,科学家用一种称为“超酸”的化合物H(CB11H6Cl6)和C60反应,使C60获得一个质子,得到一种新型离子化合物[HC60]+[CB11H6Cl6]-。该反应看起来很陌生,其实在反应类型上可以跟中学化学里某个熟悉的化学反应相类似。该化学反应是:
A.H2O+CH3COOH H3O++CH3COO- H3O++CH3COO- |
| B.Zn+2HCl = ZnCl2+H2↑ |
| C.CO2+2NH3 = CO(NH2)2+H2O |
| D.NH3+HCl = NH4Cl |
下列各组离子在常温下一定能大量共存的是
| A.pH=0的无色溶液中:Cl-、Na+、SO42-、Fe2+ |
| B.在c(H+)=10-2 mol·L-1的溶液中:NH4+、NO3-、K+、Cl- |
| C.加入铝粉能放出H2的溶液中:Ba2+、NH4+、NO3-、Cl- |
| D.含有大量Cu2+的溶液中:Al3+、S2-、Br-、Na+ |
下列离子方程式书写正确的是:
| A.向明矾溶液中加入过量的氢氧化钡溶液: Al3+ + 2SO42-+2Ba2+ + 4OH-= 2BaSO4↓+ AlO2-+ 2H2O |
| B.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-===2Fe2++I2 |
| C.NaHSO3溶液中加入过量的Ba(OH)2溶液: 2HSO3- +Ba2++2OH-===BaSO3↓+2H2O+SO32- |
| D.向含有1molFeBr2溶液中通入标准状况下22.4L的Cl2:2Br-+Cl2=Br2+2Cl- |