能用键能大小解释的事实是
| A.硝酸比磷酸易挥发 | B.金刚石的熔点比晶体硅高 |
| C.惰性气体一般很难发生化学反应 | D.通常情况下单质溴呈液态、碘呈固态 |
下列说法正确的是( )
①有化学键破坏的变化一定属于化学变化
②发生了颜色变化的一定是化学变化
③有气泡产生或固体析出的变化一定是化学变化
④用糯米、酒曲和水制成甜酒酿,一定是化学变化
⑤用鸡蛋壳膜和蒸馏水除去淀粉胶体中的食盐不涉及化学变化
| A.①②③④ | B.④⑤ | C.①③⑤ | D.全部 |
下列物质属于纯净物的是( )
①氨水②重水③明矾 ④纯碱 ⑤天然气 ⑥氧气 ⑦漂白粉 ⑧铝热剂
| A.①④⑤⑦ | B.②③④⑥ | C.④⑦⑧ | D.③⑤⑥⑧ |
下列叙述正确的是( )
| A.直径介于1~10 nm之间的粒子称为胶体 |
| B.Fe(OH)3胶体是纯净物 |
| C.利用丁达尔效应可以区别溶液与胶体 |
| D.胶体粒子很小,可以透过半透膜 |
m g铝镁合金与一定浓度的稀硝酸恰好完全反应(假定硝酸的还原产物只有NO)向反应后的混合溶液中滴加a mol/L NaOH溶液,当滴加到V mL时,得到沉淀质量恰好为最大值n g,则下列有关该实验的说法中正确的有()
①沉淀中氢氧根的质量为(n—m)g
②恰好溶解后溶液中的NO 3-离子的物质的量为aVmol
③反应过程中转移的电子的物质的量为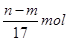
④生成NO气体的体积室温下为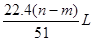
⑤与合金反应的硝酸的物质的量为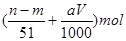
| A.2项 | B.3项 | C.4项 | D.5项 |
实验室常用下列三个反应制备Cl2:①MnO2与浓盐酸反应制备氯气;②2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2+8H2O;③KClO3+6HCl(浓)=KCl+3Cl2+3H2O如果分别用上述方法制得等量的Cl2,下列说法中正确的是 ( )
| A.参加反应的HCl的物质的量相等 |
| B.转移电子的总数相等 |
| C.消耗氧化剂的物质的量相等 |
| D.被氧化的氯离子数不相等 |