合金(仅含铜、铁)中铜和铁的物质的量之和为y mol,其中Cu的物质的量分数为a,将其全部投入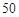 mL bmol·L
mL bmol·L 的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法正确的是( )
的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法正确的是( )
| A.若金属有剩余,在溶液中再滴入硫酸后,剩余金属一定又开始溶解 |
B.若金属全部溶解,则溶液中一定含有Fe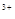 |
C.若金属全部溶解,且产生 mL气体(标准状况),则b mL气体(标准状况),则b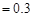 |
D.当溶液中金属离子只有Fe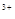 、Cu 、Cu 时,则a与b的关系为:b≥ 时,则a与b的关系为:b≥ (1 (1 a/3) a/3) |
用内置有螺旋状铜丝的胶头滴管小心吸取一滴管浓硝酸后迅速插入细口瓶中,滴管与瓶口接触处垫一小块滤纸使滴管与瓶口留少量空隙,依次观察到如下现象:①滴管内产生红棕色气体,液面下降;②滴管内的液面上升,气体变成无色;③滴管内的液面再次下降。下列说法中不正确的是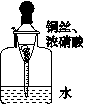
| A.现象①中产生的红棕色气体为NO2 |
| B.产生现象②的原因是NO2与水反应 |
| C.产生现象③的原因是铜与稀硝酸反应 |
| D.最终瓶内溶液中的溶质一定只有Cu(NO3)2 |
将5.6 g铁粉放入一定量某浓度的硝酸溶液中,待铁粉全部溶解后,共收集到NO、NO2(其他气体忽略不计)混合气体0.15 mol,该混合气体中NO与NO2的体积比可能是
| A.1∶2 | B.2∶1 | C.3∶2 | D.3∶1 |
下列有关溶液组成的描述合理的是
A.无色溶液中可能大量存在Al3+、NH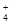 、Cl-、S2- 、Cl-、S2- |
B.酸性溶液中可能大量存在Na+、ClO-、SO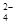 、I- 、I- |
C.弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO |
D.中性溶液中可能大量存在Fe3+、K+、Cl-、SO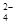 |
能正确表示下列反应的离子方程式是
| A.用过量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2= 2NH4++SO32-+H2O |
| B.磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3=3Fe3++NO↑+3H2O |
| C.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全: 2Al3++3SO42-+3Ba2++6OH -="2" Al(OH)3↓+3BaSO4↓ |
| D.Na2O2溶于水产生O2:Na2O2+H2O=2Na++2OH-+O2↑ |
同主族元素所形成的同一类化合物,其结构和性质相似。化合物PH4I是一种无色晶体,下列对它的描述错误的是
| A.它是共价化合物 | B.在加热时,它能分解 |
| C.它不能跟碱发生反应 | D.它可由PH3和HI化合而成 |