共12分) 下图中,A为芳香化合物,苯环上有两个邻位取代基: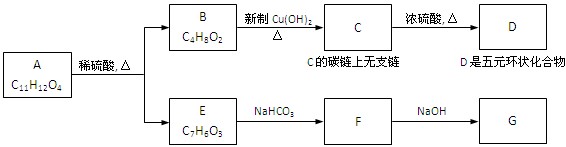
请回答:
(1)、B所含的官能团的名称是
(2)、反应C→D的化学方程式是
反应类型是
(3)、A的结构简式是 、E的结构简式是
(4)、C在一定条件下可生成一种高分子化合物H,请写出C→H的化学方程式:
。
(5)、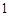 mol G的溶液可跟 mo1CO2反应
mol G的溶液可跟 mo1CO2反应
(6)、B有多种同分异构体,写出属于酯类且能发生银镜反应的同分异构体的结构简式
。
8分)Cu2S和稀HNO3反应生成Cu(NO3)2、H2SO4、NO和H2O,试解答下列各题
(1)配平上述反应方程式并标出电子转移的方向和总数
(2)当产生0.1mol NO时,转移电子总数为 ,被还原的物质为 mol,共耗HNO3 mol。
(3)被1mol Cu2S中+1价亚铜离子还原的HNO3的物质的量是 mol
在锥形分液漏斗中加入10 mL色碘水,然后再注入4 mL CCl4,盖好玻璃塞,按操作规则反复振荡后静置观察到的现象是:
操作完毕后,油层(即CCl4层)应从锥形分液漏斗的口(填“上”或“下”)放出或倒出,为得到碘并回收CCl4可用法。
根据物质的组成和性质特点,运用树状分类法对下列物质进行分类:钠(Na)、氯气(Cl2)、盐酸、硫酸(H2SO4)、碳酸钙(CaCO3)、氧化钠(Na2O)、氢氧化钠(NaOH)、空气
某溶液中可能含有SO42―、CO32―和NO3―,为了检验其中是否含有SO42―,正确的操作方法是取少量溶液置于试管中为排除干扰应先加:
再加
可能发生的离子反应方程式是:
现有200mL H2SO4和Na2SO4的混合溶液,其中硫酸的物质的量浓度为1 mol/L,硫酸钠的物质的量浓度为0.5mol/L。若要配制硫酸和硫酸钠的物质的量浓度分别为2mol/L和0.2mol/L的混合溶液,应加入55.8%的硫酸溶液(密度为1.35g/cm3)多少毫升?最后所得混合溶液的体积是多少毫升?