有0.4克铁的氧化物,用足量的CO在高温下将其还原,把生成的全部CO2通入足量澄清石灰水中,得到0.75克固体沉淀物.这种铁的氧化物的化学式为
| A.FeO | B.Fe2O3 | C.Fe3O4 | D.FeO·Fe2O3 |
可逆反应A(s)+B C达到平衡后,B的转化率与压强、温度的关系如下图,下列说法正确的是( )
C达到平衡后,B的转化率与压强、温度的关系如下图,下列说法正确的是( )
A.B是固体,C是固体,正反应是吸热反应
B.B是气体,C是固体,正反应是吸热反应
C.B是气体,C是固体,正反应是放热反应
D.B、C都是气体,正反应是放热反应
对于化学反应方向的确定,下列说法正确的是( )
| A.在温度、压强一定的条件下,焓因素和熵因素共同决定一个化学反应的方向 |
| B.温度、压强一定时,吸热的熵增反应一定能够自发进行 |
| C.反应焓变是决定反应能否自发进行的唯一因素 |
| D.固体的溶解过程与熵变无关 |
下列变化不能用勒夏特列原理解释的是( )
| A.工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率 |
B.已知反应 H2(g)+ I2(g) 2HI(g)达平衡, 加压后混合气体颜色变深 2HI(g)达平衡, 加压后混合气体颜色变深 |
| C.红棕色的NO2加压后颜色先变深再变浅 |
| D.实验室用排饱和食盐水的方法收集氯气 |
可逆反应aX(g)+bY(g) cZ(g)在一定温度下的密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)-时间(t)图像如图。下列说法正确的是( )
cZ(g)在一定温度下的密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)-时间(t)图像如图。下列说法正确的是( )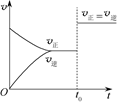
| A.若a+b=c,则t0时只能是增大反应体系的压强 |
| B.若a+b=c,则t0时只能是加入催化剂 |
| C.若a+b≠c,则t0时只能是加入催化剂 |
| D.若a+b≠c,则t0时只能是增大体系的压强 |
将0.1 mol/L的NH3·H2O溶液加水稀释,下列说法正确的是( )
| A.c(NH)/c(NH3·H2O)比值减小 | B.OH-个数将减少 |
| C.c(OH-)/c(NH3·H2O)比值减小 | D.NH4+浓度将减小 |