下图是锌和铜形成的原电池,某实验兴趣小组做完实验后,在读书卡片上写下了一些记录,其中描述合理的是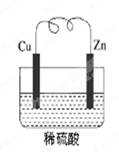
卡片:NO:28 日期:2012.6.27
实验后的记录:
①Zn为阳极,Cu为阴极;②H+向负极移动; ③电子流动方向Zn→Cu; ④Cu极有H2产生; ⑤若有1 mol电子流过导线,则产生H2为0.5 mol;
⑥正极电子反应式:Zn-2e-==Zn2+。
| A.①②③ | B.③④⑤ | C.④⑤⑥ | D.②③④ |
环境问题关系到人类的生存和发展,保护环境就是保护人类自己。从保护环境的角度出发,目前最有发展前景的一次性餐具是 ( )。
| A.瓷器餐具 | B.塑料餐具 | C.淀粉餐具 | D.不锈钢餐具 |
随着人们生活质量的不断提高,废电池必须进行集中处理的问题被提到议事日程,其主要原因是( )。
| A.利用电池外壳的金属材料 |
| B.防止电池中汞、镉和铅等重金属离子对水和土壤的污染 |
| C.不使电池中渗泄的电解液腐蚀其他物品 |
| D.回收其中石墨电极 |
下列处理垃圾的方法不合理的是( )。
| A.卫生填埋 | B.堆肥 | C.焚烧发电 | D.回收利用 |
倡导“免赠贺卡”、“免用一次性木筷”的出发点是( )。
| A.减少个人经济支出 | B.节约木材,保护森林 |
| C.减少固体垃圾 | D.移风易俗 |
保护环境是公民的责任和义务。下列说法正确的是()。
| A.大量使用含磷洗涤剂会带来白色污染 |
| B.减少使用氟氯代烷的目的是为了减少酸雨 |
| C.大量开采地下水,以满足社会对水的需求 |
| D.北京城区限制冬季燃煤供暖,是因为燃烧煤会有二氧化硫产生 |