在基态多电子原子中,关于核外电子能量的叙述错误的是
| A.最易失去的电子能量最高 | B.电离能最小的电子能量最高 |
| C.p轨道电子能量一定高于s轨道电子能量 | D.在离核最近区域内运动的电子能量最低 |
物质的量浓度相同的下列溶液中,符合按pH由小到大顺序排列的是:
A.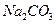 、 、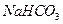 、 、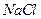 、 、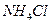 |
B.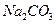 、 、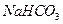 、 、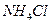 、 、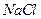 |
C.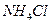 、 、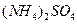 、 、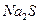 、 、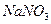 |
D.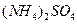 、 、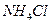 、 、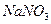 、 、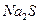 |
下列溶液分别加热蒸干,可以得到该物质晶体的是:
A.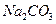 |
B.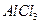 |
C.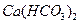 |
D.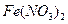 |
反应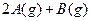

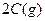
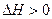 ,下列反应条件有利于生成
,下列反应条件有利于生成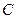 的是:
的是:
| A.低温、低压 | B.低温、高压 |
| C.高温、高压 | D.高温、低压 |
已知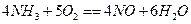 ,若反应速率分别用
,若反应速率分别用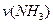 、
、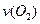 、
、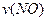 、
、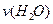 表示,则正确的关系式是:
表示,则正确的关系式是:
A.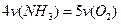 |
B.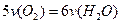 |
C.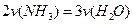 |
D. |
在一定量的密闭容器中进行反应:

 。已知反应过程中某一时刻
。已知反应过程中某一时刻 、
、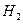 、
、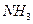 的浓度分别为0.1mol/L、0.3mol/L、0.2mol/L。当反应达到平衡时,可能存在的数据是:
的浓度分别为0.1mol/L、0.3mol/L、0.2mol/L。当反应达到平衡时,可能存在的数据是:
A. 、 、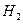 均为0.18mol/L 均为0.18mol/L |
B. 为0.15mol/L 为0.15mol/L |
C. 为0.2mol/L, 为0.2mol/L,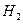 为0.6mol/L 为0.6mol/L |
D.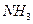 为0.4mol/L 为0.4mol/L |