已知:Ksp(AgCl)=1.8×10—10,Ksp(AgI)=1.5×10—16 ,Ksp(Ag2CrO4)=2.0×10—12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是
| A.AgCl>AgI> Ag2CrO4 | B.AgCl> Ag2CrO4>AgI |
| C.Ag2CrO4>AgCl>AgI | D.Ag2CrO4>AgI>AgCl |
S2Cl2是橙黄色液体,少量泄漏会产生窒息性气味,喷水雾可减慢挥发,并产生酸性悬浊液。其分子结构如右图所示。下列关于S2Cl2说法错误的是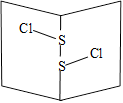
| A.为非极性分子 |
| B.分子中既含有极性键又含有非极性键 |
| C.与S2Br2结构相似,熔沸点S2Br2> S2Cl2 |
D.与水反应的化学方程式可能为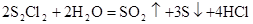 |
下表为元素周期表前四周期的一部分,下列关于R、W、X、Y、Z五种元素的叙述中正确的是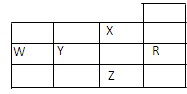
| A.W元素的第一电离能小于Y元素的第一电离能 |
| B.Y、Z的阴离子电子层结构都与R原子的相同 |
| C.最高价含氧酸的酸性,Y对应的酸性强于W |
| D.P能级未成对电子最多的是Z元素 |
下列说法中错误的是
| A.SO2、SO3都是极性分子 |
B.在 和 和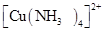 中都存在配位键 中都存在配位键 |
| C.元素电负性越大的原子,吸引电子的能力越强 |
| D.原子晶体中原子以共价键结合,具有键能大,熔点高,硬度大的特点 |
根据等电子原理判断,下列说法中错误的是
| A.B3N3H6分子中所有原子均在同一平面上 |
| B.子中存在双键,可发生加成反应 |
| C.H3O+和NH3是等电子体,均为三角锥形 |
| D.CH4和NH4+是等电子体,均为正四面体 |
氯化硼的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120o,它能水解,有关叙述正确的是
| A.氯化硼液态时能导电而固态时不导电 | B.硼原子以sp杂化 |
| C.氯化硼遇水蒸气会产生白雾 | D.氯化硼分子属极性分子 |