高炉炼铁过程中发生的主要反应为:1/3Fe2O3(s)+CO(g) 2/3Fe(s)+CO2(g)
2/3Fe(s)+CO2(g)
| 温度/℃ |
1000 |
1150 |
1300 |
| 平衡常数 |
4.0 |
3.7 |
3.5 |
已知该反应在不同温度下的平衡常数如下:
请回答下列问题:
(1)该反应的平衡常数表达式K= ,△H 0(填“>”、“<”或“=”);
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过l0 min后达到平衡。求该时间范围内反应的平均反应速率υ(CO2)= 、CO的平衡转化率= :
(3)欲提高(2)中CO的平衡转化率,可采取的措施是 。
A.减少Fe的量 B.增加Fe2O3的量 C.移出部分CO2
D.提高反应温度 E.减小容器的容积 F.加入合适的催化剂
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解。
(1)卤族元素位于周期表的_________区;溴的电子排布式为______________。
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在。使氢氟酸分子缔合的作用力是。
(3)根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是。
| 氟 |
氯 |
溴 |
碘 |
铍 |
|
| 第一电离能 (kJ/mol) |
1681 |
1251 |
1140 |
1008 |
900 |
(4)已知高碘酸有两种形式,化学式分别为H5IO6和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4(填“>”、“<”或“=”)
(5)已知ClO2-立体构型为V型。ClO2-中心氯原子的杂化轨道类型为___________,写出CN-的等电子体的化学式__________(写出1个)
(6)下图为碘晶体晶胞结构。有关说法中正确的是_____________。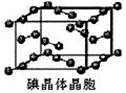
A、用均摊法可知平均每个晶胞中有4个碘原子
B、碘晶体为无限延伸的空间结构,是原子晶体
C、碘晶体中存在非极性键和范德华力
下表为元素周期表的一部分,请参照元素①-⑩在表中的位置,用化学用语回答下列问题:
| 族 周期 |
IA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
⑥ |
⑦ |
||||||
| 3 |
① |
③ |
⑤ |
⑧ |
⑩ |
|||
| 4 |
② |
④ |
⑨ |
(1)10种元素中,第一电离能最大的是______(填元素符号);电负性最小的金属是(填元素符号)。
(2) ①、③、⑤的最高价最高价氧化物对应的水化物中,碱性最强的是______________________(填化学式)。
(3) ②、③、④三种元素可形成的离子,离子半径由大到小的顺序为____________________(填离子符号)。
(4) ①和⑨两元素形成化合物的化学式为,该化合物灼烧时的焰色为
色;该化合物的溶液与元素⑧的单质反应的离子方程式为
(5) 用电子式表示第三周期元素中电负性最小的元素和电负性最大的元素形成化合物的过程。
现有下列物质:
①金刚石②干冰③氯化铵④氖⑤金属锌⑥石英⑦硫化氢
(1)通过非极性键形成原子晶体的是;属于分子晶体,且分子为直线型的是;由单原子分子构成的分子晶体是;含有极性键的离子化合物是;能导电且为金属晶体的是。(均填序号)
(2)有下列粒子:
①CCl4 ②SO3③P4④H3O+⑤CO32-⑥PH3
其中属于非极性分子的是;粒子立体构型为平面三角形的是;粒子立体构型为三角锥形的是;粒子立体构型为四面体的是。(均填序号)
(3)某+3价离子的电子排布式为1s22s22p63s23p63d5,则该元素在周期表中的位置是在周期族,画出该元素的原子结构示意图。
前四周期元素X、Y、Z、W、N核电荷数依次增加,其中X、Y、Z、W四种元素的核电荷数之和为58;Y 原子的M层p轨道有3个未成对电子;Z与Y同周期,且在该周期中电负性最大;W原子的L层电子数与最外层电子数之比为4∶1,其d轨道中的电子数与最外层电子数之比为5∶2;N3+的价电子排布式为3d5。
(1)X的元素符号为,N元素在元素周期表中的位置
(2)Y与X形成共价化合物A,Z与X形成共价化合物B,A与B还原性较强的是(写分子式)
(3)含W元素的最高化合价的含氧酸根离子是,该含氧酸根离子在分析化学中有重要作用,请写出在酸性条件下该含氧酸根离子与NSO4溶液反应的离子方程式:。
(4)W的某黑色氧化物常于实验室制取Z单质,写出该反应的化学方程式
(5)元素N的核电荷数是另一种元素Q的2倍,则Q单质与烧碱溶液反应的化学方程式为
向反应后的溶液中,通入足量CO2,反应的离子方程式为
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素
| a |
b |
c |
d |
e |
|||||||||||||
| f |
g |
h |
i |
j |
|||||||||||||
| k |
m |
||||||||||||||||
试回答下列问题:
(1)d的基态原子电子排布图为;k的外围电子排布式为
(2)ci2的结构式为;ci2与ce2比较,沸点较低的是(写化学式)
(3)m的晶体的晶胞如图所示,则一个晶胞中m原子的个数个。每一个m周围有个M与其相邻且距离相等。
(4)根据等电子体原理,写出与d2互为等电子体的粒子、(写化学式)
(5)下列关于元素在元素周期表中的位置的叙述正确的是。
A.m位于元素周期表中第四周期、ⅡB族,属于ds区元素;
B.k位于元素周期表中第四周期、ⅣB族,属于d区元素;
C.g位于元素周期表中第三周期、ⅡA族,属于s区元素;
D.j位于元素周期表中第三周期、ⅦA族,属于ds区元素;
(6)将氨水逐滴滴入到m的硫酸盐溶液中,直至过量,现象,若加入极性较小的溶剂乙醇,现象。写出反应过程中总的离子方程式。