短周期元素W、X、Y、Z的原子序数依次增大,其中W的阴离子的核外电子数与X、Y、Z原子的核外内层电子数相同。X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质,而Z不能形成双原子分子。根据以上叙述,下列说中正确的是( )
| A.W、X、Y、Z原子的核外最外层电子数的总和为20 |
| B.上述四种元素的原子半径大小为W<X<Y<Z |
| C.有W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 |
| D.W与Y可形成既含极性共价键又含非极性共价键的化合物 |
下列叙述正确的是()
| A.纯碱、烧碱均属碱 | B.CO、SO2均属酸性氧化物 |
| C.凡能电离出H+的化合物均属酸 | D.盐类物质一定含有金属离子或铵根离子 |
下列反应属于非氧化还原反应的是( )
A.2Al+Fe2O3 2Fe+Al2O3 2Fe+Al2O3 |
B.2Mg+CO2 2MgO+C 2MgO+C |
C.N2+3H2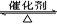 2NH3 2NH3 |
D.SiO2+CaO CaSiO3 CaSiO3 |
今有一混合物的水溶液,可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份各100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液无沉淀产生,加热后,收集到气体0.03mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量变为2.33g。
根据上述实验,下列推测正确的是()
| A.依据电荷守恒,推测一定存在K+和NH4+ |
| B.100mL溶液中含0.01mol CO32- |
| C.Ba2+一定不存在,Mg2+可能存在 |
| D.2.33g沉淀中含BaCO3和BaSO4 |
三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2。反应原理为: C3N3(OH)3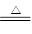 3HNCO; 8HNCO+6NO2
3HNCO; 8HNCO+6NO2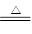 7N2+8CO2+4H2O,下列说法正确的是:()
7N2+8CO2+4H2O,下列说法正确的是:()
| A.C3N3(OH)3与HNCO为同一物质 | B.HNCO是一种很强的氧化剂 |
| C.1 mol NO2在反应中转移的电子为4 mol | D.反应中NO2是还原剂 |
氧化还原反应实际上包含氧化和还原两个过程:①向氯酸钠的酸性水溶液中通入二氧化硫,该反应中氧化过程的反应式为:SO2 + 2H2O – 2e-→ SO42-+ 4H+;②向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,该反应中还原过程的反应式为:Cl2 + 2e-→ 2Cl-,在①和②反应中均会生成产物X,则X的化学式为()
| A.NaClO | B.HClO | C.ClO2 | D.NaClO4 |