下列有关问题,与盐的水解有关的是( )
①NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂;
②用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂;
③草木灰与铵态氮肥不能混合施用;
④实验室盛放Na2CO3溶液的试剂瓶不能用磨口玻璃塞;
⑤加热蒸干AlCl3溶液得到Al(OH)3固体。
| A.①②③ | B.②③④ | C.①④⑤ | D.①②③④⑤ |
已知常温、常压下,饱和CO2溶液的pH为3.9,则可推断用已知浓度的盐酸滴定未知浓度的NaHCO3溶液时,应选用的指示剂及滴定终点的颜色变化是
| A.石蕊、由蓝变红 | B.酚酞、红色褪去 |
| C.甲基橙、由橙变黄 | D.甲基橙、由黄变橙 |
在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的是
| A.滴加石蕊试液显红色的溶液:Fe3+、NH4+、Cl-、I- |
| B.室温下,c(H+)/c(OH-)=1012的溶液:Cu2+、Na+、Mg2+、NO3- |
| C.室温下,水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+ |
| D.所含溶质为Na2SO4的溶液:K+、CO32-、NO3-、Al3+ |
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关微粒的物质的量变化如下图(其中I代表H2A,II代表HA-,III代表A2-), 根据图示判断,下列说法正确的是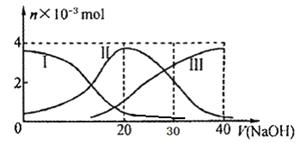
A.H2A在水中的电离方程式是:H2A===H++HA-;HA-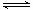 H++A2-
H++A2-
B.当V(NaOH)=20mL时,溶液中各粒子浓度的大小顺序为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
C.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水中水的电离程度大
D.当V(NaOH)=30mL时,溶液中存在以下关系:2c(H+)+ c(HA-)+ 2c(H2A)=c(A2-)+ 2 c(OH-)
常温下,将0.2 mol/L NaA溶液和0.1 mol/L盐酸等体积混合后,溶液pH>7,以下关系式错误的是
A.电荷守恒:c(Na+)+c(H+)= c(A-)+c(Cl-)+c(OH-)
B.物料守恒:c(HA)+c(A-)=0.1mol/L
C.质子守恒:c(HA)+c(H+)= c(A-)+c(OH-)
D.物料守恒:c(Na+)= c(A-)+ c(HA)
草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol•L-1 NaHC2O4溶液中滴加0.01 mol•L-1 NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的
| A.V[NaOH(aq)]=0时,c(H+)=1×10-2 mol•L-1 |
| B.V[NaOH(aq)]<10 mL时,不可能存在c(Na+)=2c(C2O42-)+c(HC2O4-) |
| C.V[NaOH(aq)]=10 mL时,c(H+)=1×10-7 mol/L |
| D.V[NaOH(aq)]>10 mL时,c(Na+)>c(C2O42-)>c(HC2O4-) |