现有如下各说法
①在水中氢、氧原子间均以化学键相结合
②金属元素和非金属元素形成的化学键为离子键。
③离子键是阳离子、阴离子的相互吸引。
④根据电离方程式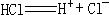 ,可判断HCl分子里存在离子键。
,可判断HCl分子里存在离子键。
⑤互为同素异形体的物质性质完全不同。
⑥分子组成相差一个或若干个“CH2”原子团的有机化合物互称为同系物
上述各种说法中正确的有几句( )
| A.0 | B.1句 | C.2句 | D.3句 |
在①硫酸②重晶石③三氧化硫④绿矾四种化合物中,硫元素的质量分数由高到底排列的顺序是()
| A.①>②>③>④ | B.②>③>④>① |
| C.①>③>②>④ | D.③>①>②>④ |
下列除去杂质的操作方法正确的是()
| A.NO中有少量的NO2:用水洗涤后再干燥 |
| B.食盐中有少量的NH4Cl:加过量的烧碱溶液后加热蒸干 |
| C.N2中有少量的O2:通过灼热的氧化铜 |
| D.硝酸钾中的少量氯化钠:溶解,低温蒸发结晶,洗涤,干燥 |
某金属氧化物化学式为R2O3,相对分子质量为102,电子数为50,已知氧原子核内有8个中子,R原子核内中子数是()
| A.27 | B.13 | C.21 | D.14 |
某非金属气态氢化物分子中的氢原子个数与该元素最高价氧化物分子中氧原子的个数之比为2:1,其氢化物与最高价氧化物相对分子质量之比为8:15,则该非金属元素的相对原子质量为()
| A.28 | B.14 | C.19 | D.32 |
CO2气体在一定条件下可与金属钠反应,干冰在一定条件下也可以形成CO2气体,这两个变化过程中需要克服的作用分别是()
| A.化学键 | B.化学键、分子间作用力 |
| C.分子间作用力、化学键 | D.分子间作用力、分子间作用力 |