已知A 是一种相对分子质量为28的气态烃,现以A为主要原料合成一种具有果香味的物质E(分子式为C4H8O2),其合成路线如下图所示。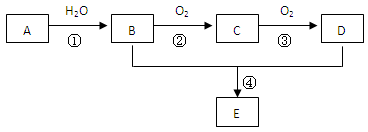
请回答下列问题:
(1)写出A的结构简式 。
(2)B、D分子中的官能团名称分别是 、 。
(3)写出下列反应的化学方程式:
① ;反应类型: 。
④ ;反应类型: 。
在80℃时,0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) n(mol) |
0 |
20 |
40 |
60 |
80 |
100 |
| n(N2O4) |
0.40 |
a |
0.20 |
c |
d |
e |
| n(NO2) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
(1)计算20s~40s内用N2O4表示的平均反应速率为。
(2)计算在80℃时该反应的平衡常数K。
(3)反应进行至100s后将反应混合物的温度降低,混合气体的颜色(填“变浅”、“变深”或“不变”)。
(4)要增大该反应的K值,可采取的措施有(填序号),若要重新达到平衡时,使[NO2]/[N2O4]值变小,可采取的措施有(填序号)。
| A.增大N2O4的起始浓度 | B.向混合气体中通入NO2 |
| C.使用高效催化剂 | D.升高温度 |
(5)如右图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线。
锌钡白是BaSO4和ZnS的混合物,ZnS难溶于水。某化工厂用重晶石为原料制备锌钡白,生产过程中会产生大量废气(主要成分为CO2、CO及少量SO2和硫蒸气等),为防止污染空气并提高原料利用率,生产中采用下述工艺流程:
请根据上述流程回答下列问题:
(1)重晶石的化学式为_________,锌钡白可用于调制_______色和浅色油漆。
(2)处理过程(a)的步骤为:①_____________;②洗涤;③______________。
(3)设备1是冷却分离塔,若设备1前面的导气管过长、过窄,可能使导气管堵塞,其原因是。
(4)设备2中所用的洗涤剂是NaOH溶液,则y的化学式为。写出设备2中发生反应的离子方程式: _____________________、_____________。
(5)可用法分离溶液中的钠盐,进行分离前,需要查得的是
。(数据)
(6)制备过程中得到的硫磺,除了可用来制硫酸外,其它的用途为(至少写一种)。
由丙烯经下列反应可得到F、G两种高分子化合物,它们都是常用的塑料。
(1)聚合物F的结构简式是_____________________________________。
(2)D的结构简式是___________________________________________。
(3)B转化为C的化学方程式是_________________________。
(4)在一定条件下,两分子E能脱去两分子水形成一种六元环化合物,该化合物的结构简式是______________________。
(5)E有多种同分异构体,其中一种能发生银镜反应,1mol该种同分异构体与足量的金属钠反应产生1mol H2,则该种同分异构体为__________________________。
下图是一个化学过程的示意图。已知甲池的总反应式为: 2CH3OH+3O2+4KOH2K2CO3+6H2O填写下列空白:
(1)请写出甲、乙两池的名称。甲电池是,乙池是。
(2)甲池中通入CH3OH的电极名称是,电极反应方程式为;乙池中B(石墨)电极的名称是。
(3)电解过程中,乙池溶液pH的变化为(“升高”、“降低”或“不变” )。
(4)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2mL(标准状况下)
下图为以惰性电极进行电解。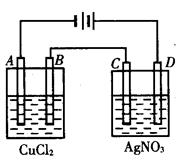
(1)写出A、B、C、D各电极上的电极方程式:
A_________________________B_______________________
C_________________________D_______________________
(2)在A、B、C、D各电极上析出生成物的物质的量比