下列各组元素中,第一电离能依次减小的是( )
| A.H Li Na K | B.Na Mg Al Cl | C.I Br Cl F | D.F O N C |
升高温度反应速度加快的主要原因是
| A.分子运动速度加快 | B.活化能增加 |
| C.体系能量增加 | D.活化分子的百分数增加 |
室温下,把1 mL 0.1 mol·L-1的H2SO4加水稀释成2 L溶液,在此溶液中由水电离产生的H+,其浓度接近于
| A.1×10-4 mol·L-1 | B.1×10-8 mol·L-1 |
| C.1×10-11 mol·L-1 | D.1×10-10 mol·L-1 |
一定温度下,在体积为10L的密闭容器中充满NH3,反应2NH3 3H2+N2经5s达到平衡,经测定NH3和H2的浓度均为amol/L,下列叙述中不正确的是
3H2+N2经5s达到平衡,经测定NH3和H2的浓度均为amol/L,下列叙述中不正确的是
| A.反应前后的压强比为5:7 | B.达到平衡时NH3的分解率为40% |
C.N2的平衡浓度为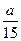 mol/(L·s) mol/(L·s) |
D.NH3在5s内的平均速度为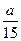 mol/(L·s) mol/(L·s) |
在某温度时,测得纯水中的c(H+)=2.0×10-7 mol·L-1,则c( OH-)为
OH-)为
| A.2.0×10-7 mol·L-1 | B.0.1×10-7 mol·L-1 |
| C.1.0×10-14/2.0×10-7 mol·L-1 | D.无法确定 |
在aLAl2(SO4)3和(NH4)2SO4的混合溶液分成两等分,一份加入bmol的BaCl2,恰好使溶液中的SO42-完全沉淀;另一份加入足量强碱并加热可得到cmolNH3,则原溶液中的Al3+的浓度(mol/L)为
| A.(2b-c) /3 a | B.(2b-c)/a | C.(4b-2c)/3a | D.(4b-2c)/a |