下列物质性质的变化规律,与化学键的强弱无关的是( )
| A.F2、Cl2、Br2、I2的熔点、沸点逐渐升高 |
| B.HF、HCl、HBr、HI的热稳定性依次减弱 |
| C.金刚石的硬度、熔点、沸点都高于晶体硅 |
| D.NaF、NaCl、NaBr、NaI的熔点依次降低 |
设NA为阿伏加德罗常数的值,下列说法正确的是()
| A.隔绝空气加热6.4g铜与3.2g硫单质的混合物,充分反应后转移的电子数是0.2NA |
| B.3.6g金刚石中共用电子对数目是1.2NA |
| C.1mol/L Na2SO4溶液中钠离子的数目是2NA |
| D.常温下在1L pH=1盐酸中已电离的水分子数目是10-13NA |
下列用来表示物质变化的化学用语中,正确的是()
| A.若某条件下H2(g)的燃烧热是285.8Kj/mol,则2H2O(g)=2H2(g)+O2(g) △H=+571.6KJ/mol |
| B.硫酸铵浓溶液与氢氧化钠浓溶液混合加热:NH4++OH-=NH3·H2O |
C.NaAlO2水解反应的离子方程式:AlO2-+2H2O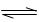 Al(OH)3+OH+ Al(OH)3+OH+ |
| D.用惰性电极电解饱和氯化钠溶液时阴极电极反应式:2Cl--2e-=Cl2↑ |
2009年4月23日下午,在青岛解放军码头举行了庆祝中国人民解放军60周年仪式。下列与海军舰艇有关的说法中不正确的是()
| A.涂在舰艇上的隐身纳米涂料中的空心微粒的直径约是4mm左右,该空心微粒与水组成的混合物可发生丁达尔现象 |
| B.舰艇在海水中比在江河中更容易腐蚀,是因为海水中含氧量大 |
C.参加阅兵的舰艇中使用的生氧剂是过氧 化钠,可实现潜艇舱内的空气交换 化钠,可实现潜艇舱内的空气交换 |
| D.舰艇内部通信采用的光纤(SiO2)和机舱发动机采用的氧化铝陶瓷都属于新型无机非金属材料 |
下列说法正确的是
| A.第一电离能大的原子一定不能发生化学反应 |
| B.X、Y位于同周期,X电负性大于Y电负性则X的第一电离能一定大于Y的第一电离能 |
| C.在所有元素中,氦的第一电离能最大 |
| D.元素的电负性越大则元素的非金属性越弱 |
在元素周期表中的前四周期,两两相邻的五种元素如图所示。若B元素的核电荷数为a,则五种元素的核电荷总数之和可能为①5a、②5a+18、③5a+10、④5a+8
| A.只有①、③ | B.只有① |
| C.只有③ | D.全部 |