在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
| 物质 |
X |
Y |
Z |
| 初始浓度/mol·L-1 |
0.1 |
0.2 |
0 |
| 平衡浓度/mol·L-1 |
0.05 |
0.05 |
0.1 |

 下列说法错误的是:
下列说法错误的是:


 A.反应达到平衡时,X的转化率为50%
A.反应达到平衡时,X的转化率为50% B.反应可表示为X+3Y
B.反应可表示为X+3Y 2Z,其平衡常数为1600
2Z,其平衡常数为1600 C.增大压强使平衡向生成Z的方向移动,平衡常数减小
C.增大压强使平衡向生成Z的方向移动,平衡常数减小 D.改变温度可以改变此反应的平衡常数
D.改变温度可以改变此反应的平衡常数
下列离子中,所带电荷数与该离子的核外电子层数相等的是
| A.Al3+ | B.Mg2+ | C.Be2+ | D.H+ |
某元素的原子核外有3个电子层,最外层有7个电子,该原子核内的质子数为
| A.14 | B.15 | C.16 | D.17 |
在元素周期表中,第三、四、五、六周期元素的数目分别是
| A.8、8、18、32 | B.8、18、18、32 |
| C.8、18、18、18 | D.8、8、18、18 |
19世纪中叶,门捷列夫的突出贡献是
| A.提出原子学说 | B.发现元素周期律 | C.提出分子学说 | D.最早发现了氧气 |
某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol·L-1的盐酸,测得溶液中的CO2-3、HCO-3、AlO—3、Al3+离子的物质的量与加入盐酸溶液的体积变化关系如图所示,则下列说法正确的是()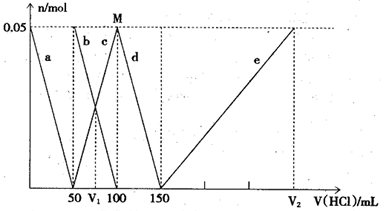
| A.原混合溶液中的CO2-3与AlO—2的物质的量之比为1:2 |
| B.V1:V2=l:5 |
| C.M点时生成的CO2为0.05mol |
| D.a曲线表示的离子方程式为:AlO—2+H++H2O=Al(OH)3↓ |