在不同温度下,反应CO2(g)+H2(g) CO(g)+H2O(g)的平衡常数K如下表:
CO(g)+H2O(g)的平衡常数K如下表:
| 温度/℃ |
700 |
800 |
850 |
1000 |
1200 |
| 平衡常数K |
2.6 |
1.7 |
1 |
0.9 |
0.6 |
(1)该反应的△H 0。(填“>”、“=”或“<”)。若到达平衡后升高温度,则CO2的转化率将 ,正反应速率 (填“增大”、“减小”或“不变”)。
(2)850℃时发生上述反应,CO2的转化率随时间变化如图所示。其他条件相同时,请在下图中画出700℃时CO2的转化率随时间变化的示意图(注明必要的标示)。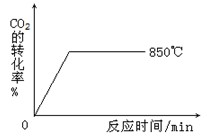
(3)在850℃时发生上述反应,以下表中的物质的量投入恒容反应器,其中向正方向移动的组是 (填代号),平衡后与C中各物质的百分含量相等的组有__________(填代号 )
| |
A |
B |
C |
D |
E |
| n(CO2)[ |
3 |
1 |
0 |
1 |
1 |
| n(H2) |
2 |
1 |
0 |
1 |
2 |
| n(CO) |
1 |
2 |
3 |
0.5 |
3 |
| n(H2O) |
5 |
2 |
3 |
0.5 |
1 |
(4) 850℃时,在1L的密闭容器中分别充入2mol的CO2和H2,计算反应到达平衡时CO的物质的量浓度。(写出计算过程)
A、B、C、D四种化合物的焰色反应均为黄色;C、D与盐酸生成一种无色无味气体E,该气体能使澄清石灰水变浑浊;D和A可反应生成C;B和E反应可生成C和另一种无色无味气体F。请回答下列问题:
(1)写出A的电子式:。
(2)写出B和E反应的化学方程式:,该反应中氧化剂是还原剂是。
(3)写出D和盐酸反应的离子方程式:。
现有下列十种物质:①H2②铝③甲烷④CO2⑤H2SO4⑥Ba(OH)2⑦红褐色的氢氧化铁胶体⑧氨水⑨盐酸⑩Al2(SO4)3
(1)上述物质中属于电解质的有:。(填序号)
(2)上述十种物质中有两种物质在水溶液中可发生反应,离子方程式为:H++OH- H2O,该反应的化学方程式为。
H2O,该反应的化学方程式为。
(3)⑩在水中的电离方程式为,17.1g该物质溶于水配成250mL溶液,物质的量浓度为mol·L-1。
(4)⑨的浓溶液与二氧化锰发生反应的化学方程式为:4HCl(浓)+MnO2 Cl2↑+MnCl2+2H2O,该反应的氧化剂是(填化学式),还原剂与氧化剂的物质的量之比是。写出该反应的离子方程式。
Cl2↑+MnCl2+2H2O,该反应的氧化剂是(填化学式),还原剂与氧化剂的物质的量之比是。写出该反应的离子方程式。
含有相同氧原子数的CO和CO2,其质量比为;物质的量比为;碳原子数比为;原子数比为。
为下列混合物的分离或提纯提供正确的方法:
(1)除去食盐水中的泥沙;
(2)分离水和汽油的混合物;
(3)分离四氯化碳(沸点为76.75℃)和甲苯(有机溶剂,与CCl4互溶。沸点为110.6℃)的混合物;
(4) 从食盐水中提取氯化钠。
实验室可用KMnO4和浓盐酸反应制取氯气。其变化可表述为:
()KMnO4+( )HCl(浓)===( )KCl+()MnCl2+()Cl2↑+( )[ ]
(1)请完成该化学方程式并配平(未知物化学式和化学计量数填入框内)。
(2)请将上述配平的化学方程式改写为离子方程式。
(3)浓盐酸在反应中显示出来的性质是________________(填写编号,多选倒扣)。
①只有还原性②还原性和酸性
③只有氧化性④氧化性和酸性
(4)产生0.1molCl2,则转移的电子的物质的量为______mol。
(5)ClO2具有很强的氧化性。因此,常被用作消毒剂,其消毒的效率(以单位质量得到的电子数来衡量)是Cl2的______倍。