某化学兴趣小组同学进行如下实验。
(1)使用铜和稀硫酸制备硫酸铜晶体。步骤如下: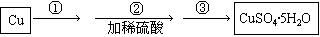
步骤①观察到的现象是: 。
步骤③的主要操作包括: 。
(2)某同学查资料知:铜与稀硫酸不反应,若在稀硫酸中加入H2O2,铜可逐渐溶解。实验装置如图,写出该反应的化学方程式: 。
(3)铜粉放入稀硫酸中,加热后无明显现象发生。当加入一种物质后,铜粉开始溶解,溶液变蓝色,同时有气体逸出,该物质是 (填字母);
| A.Al2(SO4)3 | B.Na2CO3 | C.KNO3 | D.FeSO4 |
写出该反应的离子方程式 。
X、Y、Z、W是原子序数依次增大的前四周期元素,已知:
①X元素原子的最外层电子数是次外层的2倍;
②Y元素原子的p轨道上有2个未成对电子;
③Z元素在同一短周期元素中的原子半径最大;
④W元素原子的最外层电子数与Z相同,其余各电子层均充满电子。
请回答下列问题:
(1)X、Y、Z三种元素的第一电离能从小到大的顺序是(用元素符号表示,下同);
(2)W元素原子核外电子排布式是;
(3)Z元素与氢元素形成的化合物熔点比Y元素的氢化物熔点高,原因是;
(4)X的一种氢化物相对分子质量为42,分子中含有σ键和π键的个数比为8︰1,则该分子中X原子的杂化类型是和。
(5)Y的最简单氢化物可以和W2+形成配位键,而X的最简单氢化物则不行,其原因是。
(1)常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
①写出酸H2A的电离方程式__________________________。
②若溶液M由2 mol·L-1NaHA溶液与2mol·L-1NaOH溶液等体积混合而得,则溶液M的pH ____7 (填“>”、“<”或“=”);溶液M中各微粒的浓度关系正确的是。
A.c(Na+)>c(A2-)>c(OH-) >c(H+)
B. c(HA-) +c(H2A) +c(H+)=c(OH-)
C.c(A2-)+c(HA-) +c(H2A)=1 mol·L-1
D. c(A2-)+c(HA-)+c(OH-)=c(Na+)+c(H+)
(2)室温时,氢氧化钙的溶度积KSP =4.7×10-6, 室温时将9 mL0.02 mol·L—1的氯化钙溶液与1 mL pH=13的氢氧化钠溶液混合后(溶液体积可直接加和),溶液中___沉淀析出(填“有”或“无”)。
(3) 某校课外活动小组为测定已部分脱水的生石膏的组成(xCaSO4·yH2O),做如下实验:将固体加热,经测量剩余固体质量随时间变化如图所示。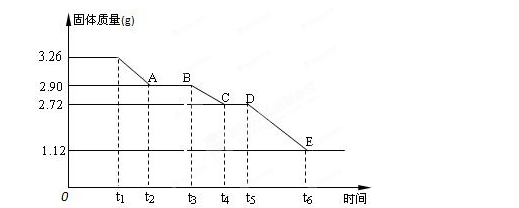
则x:y=。t2~t3时间段固体的化学式为。t5~t6时间段固体质量减轻的原因是产生了两种气体,其中一种能使品红溶液褪色。则该时间所发生反应的化学方程式为。
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
___ C+ ___ KMnO4+6 H2SO4 = ____CO2↑+ ____MnSO4 + ____K2SO4+ 6H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g) CO2(g)+H2(g),得到如下二组数据:
CO2(g)+H2(g),得到如下二组数据:
| 实验组 |
温度℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
| CO |
H2O |
H2 |
CO |
|||
| 1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
| 2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
①实验1中以v(CO2)表示的反应速率为(保留小数点后二位数,下同)。
②实验2条件下平衡常数K=_________,该反应为(填“吸”或“放”)热反应。
(3)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g)ΔH =-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g)ΔH =-566.0 kJ/mol
③ H2O(g) = H2O(l)ΔH =-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
⑷某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。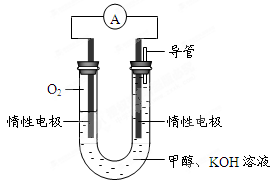
①该电池正极的电极反应为
②该电池工作时,溶液中的OH-向______极移动
氯气是氯碱工业的主要产品之一,它是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:
Cl2 + H2O  HCl + HClOK=4.5×10-4
HCl + HClOK=4.5×10-4
次氯酸的强氧化性能杀死水中的病菌(不直接用次氯酸为自来水消毒是因为次氯酸易分解,且毒性较大)。但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其它性能优越的消毒产品所替代。请回答:
(1)氯碱工业生产氯气的化学方程式为。
(2)84消毒液(主要成分为NaClO)与氯气相比具有贮运方便等优点,用氯气与烧碱溶液反应制备84消毒液的离子方程式为。
(3)二氧化氯是一种高效、广谱、安全的杀菌、保鲜剂。我国科学家研发了用氯气氧化亚氯酸钠(NaClO2)固体制备二氧化氯的方法,其化学方程式为。
(4)一位同学设计了一套用浓盐酸和KMnO4固体制取少量氯气并比较氯气与碘单质的氧
化性强弱的微型装置(如图)。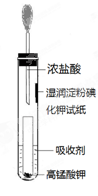
①下列溶液能吸收Cl2的是(填字母序号)。
| A.饱和食盐水 | B.饱和Na2SO3溶液 |
| C.饱和NaOH溶液 | D.浓硫酸 |
②能说明Cl2的氧化性强于I2的实验现象是。
(7分)下表是元素周期表的一部分,请参照元素①-⑧在表中的位置,回答下列问题:
| 族 周期 |
IA |
0 |
||||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
② |
③ |
④ |
|||||
| 3 |
⑤ |
⑥ |
⑦ |
⑧ |
(1)①-⑧中金属性最强的元素是(元素符号)___________。
(2)④、⑤、⑦的原子半径由大到小的顺序为(元素符号)________________________。
(3)②、③、⑧的最高价含氧酸的酸性由强到弱的顺序是(填化学式)_______________。
(4)由②和④组成的化合物与⑥单质反应的化学方程式为_________________________。
(5)⑦单质与⑤的最高价氧化物的水化物反应的离子方程式为。