【化学选修-化学与技术】(15分)将磷肥生产中形成的副产物石膏(CaSO4•2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义.以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图.
(1)本工艺中所用的原料除CaSO4•2H2O、KCl外,还需要___________________等原料.
(2)写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式_________________.
(3)过滤Ⅰ操作所得固体中,除CaCO3外还含有________(填化学式)等物质,该固体可用作生产水泥的原料.
(4)过滤Ⅰ操作所得滤液是(NH4)2SO4溶液.检验滤液中含有CO32﹣的方法是__________________.
(5)已知不同温度下K2SO4在100g水中达到饱和时溶解的量如下表:
| 温度(℃) |
0 |
20 |
60 |
| K2SO4溶解的量(g) |
7.4 |
11.1 |
18.2 |
60℃时K2SO4的饱和溶液591g冷却到0℃,可析出K2SO4晶体___________g.
(6)氯化钙结晶水合物(CaCl2•6H2O)是目前常用的无机储热材料,选择的依据是_______.
A.熔点较低(29℃熔化)b.能导电
c.能制冷d.无毒
(7)上述工艺流程中体现绿色化学理念的是________________________________.
(12分)Cr2O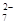 和CN-是工业废水中常见的污染物.若利用下列流程可对分别含两种离子的废水进行综合处理:
和CN-是工业废水中常见的污染物.若利用下列流程可对分别含两种离子的废水进行综合处理: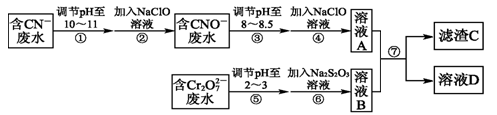
已知:Cr3+也有一定毒性,Cr3+在pH=6.0时开始沉淀,pH=8.0时沉淀完全.
回答下列问题:
(1)已知步骤②中无气体生成,写出反应的离子方程式______________________.
步骤④中NaClO可将CNO-处理为完全无害的溶液,该过程中有两种无毒的不支持燃烧的气体产生,写出这两种气体的化学式____________________________.
(2)步骤⑥的反应为S2O32-+Cr2O72-+H+―→SO42-+Cr3++H2O(未配平),则每处理1 mol Cr2O72-转移________mol电子.
(3)滤渣C的化学式为Cr(OH)3,溶液A和溶液B混合可使废水中的Cr3+沉淀的原因是______________________________________________________.
(4)步骤⑦的操作名称为___________,若该操作在实验室中进行,则所需的玻璃仪器为________.
(16分)氢是一种重要的非金属元素.氢的单质及其化合物在科学研究和工业生产中有着广泛而重要的作用。
(1)NaH是一种生氢剂,NaH与H2O反应放出H2.NaH含有的化学键为________(填“离子键”或“共价键”),NaH与H2O反应的化学方程式为________________.
(2)写出实验室用锌与稀硫酸反应制取H2的离子方程式:_________.图中三根曲线表示锌、铝、铁分别与稀硫酸反应时金属质量与H2体积的关系,其中能表示铝的是________(填“a”“b”或“c”).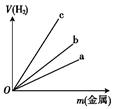
(3)金属-有机框架物(MOFs)储氢材料是由金属氧化物团簇通过有机高分子链组装形成的晶态材料.MOFs储氢材料比表面积大,空隙率高,储氢容量大,其储氢和放氢的原理可表示为MOFs(s)+nH2(g)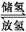 (H2)nMOFs(s),ΔH<0,则储氢时的适宜条件为________(填字母).
(H2)nMOFs(s),ΔH<0,则储氢时的适宜条件为________(填字母).
| A.低温低压 | B.低温高压 | C.高温低压 | D.高温高压 |
(4)某硝酸厂处理尾气中的NO的方法是用H2将NO还原为N2.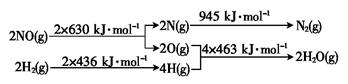
已知:H2还原NO生成氮气和水蒸气的热化学方程式是_________________________.
(5)一定条件下,用H2将二氧化碳转化为甲烷的反应如下:
CO2(g) + 4H2(g) CH4(g) + 2H2O(g)
CH4(g) + 2H2O(g)
向一容积为2 L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,10 min后达到平衡时各物质的浓度分别为: CO2为0.2 mol·L-1, H2为0.8 mol·L-1, CH4为0.8 mol·L-1, H2O为1.6 mol·L-1.
①0~10 min内v(H2)=_______________.
②300℃时上述反应的平衡常数K=___________,若200℃时该反应的平衡常数K=64.8,则该反应的ΔH__________(填“>”或“<”)0.
(12分)氮元素可形成氢化物、卤化物、氮化物、叠氮化物和配合物等多种化合物。
(1)肼(N2H4)可用作火箭燃料,其原理是:N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g),若反应中有4mol N-H 键断裂,则形成的π键有mol。
(2)F2和过量NH3在铜催化作用下反应生成NF3,NF3分子的空间构型为。
(3)铁和氨气在640℃发生置换反应,产物之一的晶胞见图1。该反应的化学方程式:。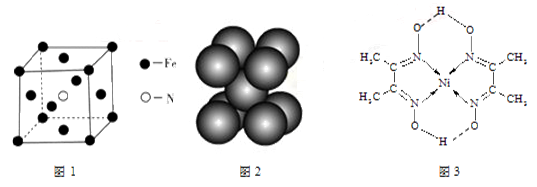
(4)叠氮化钠(NaN3)分解反应为:2NaN3(s)=2Na(l)+3N2(g),下列有关说法正确的是。
a.常温下N2很稳定,是因为N的电负性大
b.钠晶胞见图2,每个晶胞含有2个钠原子
c.第一电离能(I1):N>O>S
d.NaN3与KN3结构类似,晶格能:NaN3<KN3
(5)配合物Y的结构见图3,Y中含有(填序号);
a.极性共价键b.非极性共价键c.配位键 d.氢键
Y中碳原子的杂化方式有。
研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下放热反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1∆H ="a" kJ/mol (I)
NaNO3(s)+ClNO(g) K1∆H ="a" kJ/mol (I)
2NO(g)+Cl2(g) 2ClNO(g) K2∆H ="b" kJ/mol (II)
2ClNO(g) K2∆H ="b" kJ/mol (II)
(1)反应4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=(用K1、K2表示),∆H=kJ/mol(用a、b表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=(用K1、K2表示),∆H=kJ/mol(用a、b表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内v(ClNO)=7.5×10-3mol•L-1•min-1,则平衡后
n(Cl2)=mol。其它条件保持不变,反应(II)在恒压条件下进行,平衡常数K2(填“增大”“减小”或“不变”)。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol•L‾1的CH3COONa溶液,则两溶液中c(NO3‾)、c(NO2-)和c(CH3COO‾)由大到小的顺序为。(已知HNO2的电离常数Ka=7.1×10-4mol•L‾1,CH3COOH的电离常数K a=1.7×10-5mol•L‾1)
(4)由有机阳离子、Al2Cl7—和AlCl4—组成的离子液体作电解液时,可在钢制品上电镀铝。
钢制品应接电源的极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为。若改用AlCl3水溶液作电解液,则阴极产物为。