相同温度、相同物质的量浓度的下列各组溶液,按pH值依次减小的顺序排列的是( )
| A.CH3COONa、Na2CO3、NaHSO4、NaCl | B.HCl、CH3COOH、NH4Cl、NaHCO3 |
| C.NaOH、Ba(OH)2、H2SO4、HCl | D.NH4Cl、CH3COOH、NaHSO4、H2SO4 |
下图装置可用于收集气体X并验证其某些化学性质,你认为正确的是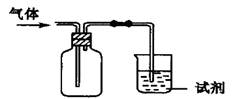
| 选项 |
气体 |
试剂 |
现象 |
结论 |
| A |
SO2 |
酸性KMnO4 |
溶液褪色 |
SO2有还原性 |
| B |
NH3 |
酚酞溶液 |
溶液变红 |
氨水呈碱性 |
| C |
X |
澄清石灰水 |
溶液变浑浊 |
气体一定是CO2 |
| D |
Cl2 |
紫色石蕊试液 |
溶液先变红后褪色 |
Cl2有酸性和漂白性 |
下列离子反应,表达正确的是
| A.向Fe(OH)3悬浊液中通入HI: Fe(OH)3 + 3H+= Fe3+ + 3H2O |
| B.用醋酸除热水瓶中的水垢: CaCO3 + 2CH3COOH=Ca2+ + 2CH3COO- + CO2↑+ H2O |
| C.向硫酸氢钾溶液中加入Ba(OH)2溶液至pH=7: 2H+ + SO42-+ Ba2+ + 2OH-= BaSO4↓ + 2H2O |
| D.MgSO4溶液跟Ba(OH)2溶液反应: SO42― + Ba2+=BaSO4↓ |
一定条件下,在容积为10L的密闭容器中,将l mol X和1 mol Y进行如下反应:2X(g)+Y(g)  Z(g),经60 s达到平衡生成0.3 mol的Z,下列说法正确的是
Z(g),经60 s达到平衡生成0.3 mol的Z,下列说法正确的是
| A.60 s时Z的平衡浓度为0.03 mol/L |
| B.将容器容积变为20 L,Z的新平衡浓度将等于原平衡浓度的一半 |
| C.若温度和体积不变,往容器内增加1 mol N2,压强增大,Y的转化率将增大 |
| D.若升高温度,X的体积分数增大,则正反应的△H>0 |
右图中a、b、c、d、e、f为元素周期表中前4周期的相邻的一部分元素,下列有关叙述正确的是:
| A.b、c、d 三种元素的原子半径大小关系:d> c> b |
| B.六种元素中,d元素的性质最稳定 |
| C.c和f的气态氢化物,前者比后者稳定 |
| D.e元素的最高价氧化物的水化物是二元酸 |
设NA为阿伏加德罗常数,以下叙述正确的是
| A.标准状况下,22.4L苯中所含分子数为1NA |
| B.常温常压下,11.2L甲烷中含有的氢原子数为2NA |
| C.标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为NA |
| D.1molNH4+所含有的质子数目为10NA |