下列排序不正确的是
| A.沸点I2 > Br2 > Cl2 > F2 | B.氧化性F2 > Cl2 > Br2 > I2 |
| C.热稳定性HF > HCl > HI > HBr | D.原子半径I > Br > Cl > F |
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子 数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76 g/L-1;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是()
数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76 g/L-1;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是()
| A.元素原子第一电离能大小关系:Z>Y>W>X>M |
| B.XZ2、X2M2、W2Z2均为直线形的共价化合物 |
| C.Y与M形成化合物键长大于Z与M形成化合物的键长 |
| D.由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
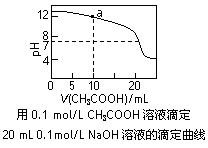
下列各表述与示意图一致的是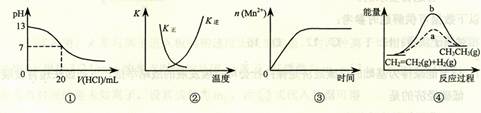
| A.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化 |
B.图②中曲线表示反应2SO2(g) + O2(g)  2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化 2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化 |
| C.图③表示10 mL 0.01 mol·L-1 KMnO4酸性溶液与过量的0.1 mol·L-1 H2C2O4溶液混合时(ΔH >0),n(Mn2+) 随时间的变化 |
D.图④中a、b曲线分别表示反应CH2=CH2 (g) + H2(g) CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化 CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化 |
M是一种冶疗艾滋病的新药(结构简式见右图),已知M分子中-NH-COO-基团
(除H外)与苯环在同一平面内,关于M的以下说法正确的是 
| A.该物质易溶于水 |
| B.M能发生加聚反应 |
| C.M的分子式为C13H12O2NF4 |
| D.M分子内至少有13个碳原子在同一平面内 |
某恒温密闭容器发生可逆反应Z(?)+W(?) X(g)+Y(?) ΔH ,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中不正确的是
X(g)+Y(?) ΔH ,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中不正确的是
| A.Z和W在该条件下一定不为气态 |
| B.t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等 |
| C.若在该温度下此反应平衡常数表达式为K=c(X),则t1~t2时间段与t3时刻后的X 浓度相等 |
| D.若该反应只在某温度T0以上自发进行,则该反应的平衡常数K随温度升高而增大 |
下列有关溶液中粒子浓度的关系式中,正确的是
A.pH相同的①CH3COONa、②NaHCO3、③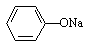 三份溶液中的c(Na+):③>②>①
三份溶液中的c(Na+):③>②>①
B.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中: c(Na+)=2c(A2-)+c(HA-)+c(H2A)
C.右图中pH=7时:c(Na+)>c(CH3COO-) >c(OH-)=c(H+)
D.右图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH)