对已达化学平衡的下列反应:2X(g)+Y(g)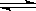 2Z(g),减小压强时,对反应产生的影响是( )
2Z(g),减小压强时,对反应产生的影响是( )
| A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动 |
| B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动 |
| C.正、逆反应速率都减小,平衡向逆反应方向移动 |
| D.正、逆反应速率都增大,平衡向正反应方向移动 |
等物质的量浓度的下列溶液中,c(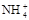 )最大的是()
)最大的是()
| A.NH4HCO3 | B.NH4NO3 | C.(NH4)2CO3 | D.NH4HSO4 |
已知25℃、101kPa下,如图所示,石墨的燃烧热为393.5kJ/mol,金刚石的燃烧热为395.0kJ/mol 。下列说法或表达正确的是:
| A.金刚石比石墨稳定 |
| B.C(s、石墨)=C(s、金刚石)△H =+1.5kJ/mol |
| C.△H1<△H2 |
| D.如果使用催化剂,△H1和△H2都变小 |
往含I-和Cl-的稀溶液中滴入AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如右图所示。则原溶液中c(I-)/c(Cl-)的比值为( )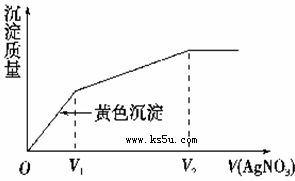
| A.(V2-V1)/V1 | B.V1/V2 |
| C.V1/(V2-V1) | D.V2/V1 |
在0.1mol/L的醋酸溶液中,存在平衡:CH3COOH CH3COO- +H+下列说法正确的是()
CH3COO- +H+下列说法正确的是()
| A.加水稀释,中和此溶液所需的0.1mol/LNaOH溶液的体积增大 |
| B.加入固体碳酸钠,平衡正向移动,c(CH3COOH)减小 |
| C.加入固体醋酸钠,平衡逆向移动,c(H+)、c(CH3COO-)均减小 |
| D.加水稀释,电离程度增大,由CH3COOH电离出来的n(H+)增大 |
常温下,将甲酸与NaOH溶液混合,所得溶液的pH=7,则此溶液中()
| A.c(HCOO-)>c(Na+) |
| B.c(HCOO-)<c(Na+) |
| C.c(HCOO-)= c(Na+) |
| D.无法确定c(HCOO-)与c(Na+)的关系 |