在一固定体积的密闭容器中加入2molA和1molB发生反应2A(g)+B(g)  3C(g)+D(g),达到平衡时C的浓度为w mol·L-1,若维持容器的体积和温度不变,按下列四种配比方案作为反应物,达平衡后,使C的浓度仍为w mol·L-1的配比是( )
3C(g)+D(g),达到平衡时C的浓度为w mol·L-1,若维持容器的体积和温度不变,按下列四种配比方案作为反应物,达平衡后,使C的浓度仍为w mol·L-1的配比是( )
| A.4 mol A+2 mol B | B.3 mol C+1 mol D+2mol A+1 mol B |
| C.3mol C+1 mol D+1 mol B | D.3 mol C+1 mol D |
原子结构模型是科学家根据自己的认识,对原子结构的形象描述。一种原子模型代表了人类对原子结构认识的一个阶段。描述电子在原子核外空间的一定轨道上绕核做高速圆周运动的原子模型是( )
| A.玻尔原子模型 |
| B.电子云模型 |
| C.汤姆生原子模型 |
| D.卢瑟福原子模型 |
环氧乙烷与乙二醇作用,控制一定的反应条件及反应物的用量比例,可生成一系列双官能团化合物,称为多缩乙二醇醚,其反应原理可表示为:
求该系列化合物中碳元素的质量分数的最大值约为
| A.40.00% | B.54.54% | C.66.67% | D.85.81% |
草药莪术根茎中含有一种色素,它的结构为CH2—(—CO—CH=CH— —OH) 2,用它制成的试纸可以检验酸碱性,能够跟1mol该化合物起反应的Br2(水溶液)或H2的最大量分别为
—OH) 2,用它制成的试纸可以检验酸碱性,能够跟1mol该化合物起反应的Br2(水溶液)或H2的最大量分别为
| A.3mol,3mol | B.3mol,5mol | C.6mol,8mol | D.6mol,10mol |
美国康乃尔大学的魏考克斯(C. Wilcox)所合成的一种有机分子,就像一尊释迦牟尼佛,因而称为释迦牟尼分子(如右图,所有原子在同一平面上)。有关该有机分子的说法正确的是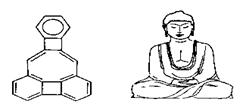
A.该有机物属于芳香族化合物B.该有机物属于苯的同系物
C.该有机物分子中含有20个碳原子D.该有机物一氯代物只有3种
在下列有关说法中正确的是
①相同质量的CH4、C2H4、C2H2完全燃烧时耗O2量的关系为CH4 > C2H4 >C2H2
②对于任意比混合的乙烯、丙烯和环丁烷混合气体在足量氧气中燃烧,只要混合气体的质量不变,完全燃烧后产生的CO2和H2O的量也不改变
③对于任意比混合的C2H4、C2H6、C2H2混合气体,只要混合气体物质的量不变,完全燃烧后产生的CO2物质的量也不改变
④某有机物在足量氧气中燃烧后产生CO2与H2O的物质的量之比为2:3,则该有机物的类型肯定为烷烃
| A.①②③ | B.①②③④ | C.②③ | D.以上组合均不正确 |