下列叙述中,错误的是
| A.原子半径:Na>Mg>O |
| B.13C和14C属于同位素 |
| C.0族元素是同周期中非金属性最强的元素 |
| D.N和P属于第ⅤA族元素,HNO3酸性比H3PO4的强 |
如下图是周期表中短周期的一部分,W、X、Y三种元素原子核外电子数之和等于X的质量数,X原子核内质子数和中子数相等。下列叙述中不正确的是( )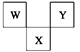
| A.三种元素的原子半径的大小顺序是W<Y<X |
| B.W最高价氧化物对应水化物具有强酸性,气态氢化物的水溶液具有弱碱性 |
| C.X元素的氧化物、氢化物的水溶液都呈酸性 |
| D.Y元素的单质是非金属单质中唯一能跟水发生剧烈反应的单质 |
目前人类已发现的非金属元素除稀有气体外,共有16种,对这16种非金属元素的相关判断:①都是主族元素,最外层电子数都大于4;②单质在反应中都只能作氧化剂;③氢化物常温下都是气态;④氧化物常温下都可以与水反应生成酸。其中不正确的有( )
| A.只有①② | B.只有①③ | C.只有③④ | D.①②③④ |
根据等电子原理:由短周期元素组成的粒子,只要其原子数相同,各原子最外层电子数之和相同,可互称为等电子体,它们具有相似的结构特性。以下各组粒子结构不相似的是( )
| A.CO和N2 | B.O3和NO | C.CO2和N2O | D.N2H4和C2H4 |
中学化学教材中有大量数据,下列为某同学对数据的利用情况,其中不正确的是()
| A.用NaOH和HCl 反应测得的中和热,推算一定量稀H2SO4和NaOH 溶液反应的反应热 |
| B.用沸点数据推测两种液体混合物用蒸馏方法分离开来的可能性 |
| C.用沸点数据来分析分子的稳定性 |
| D.用原子(或离子)半径数据推断某些原子(或离子)氧化性或还原性强弱 |
下列说法中正确的是( )
①钠在空气中燃烧生成淡黄色的Na2O2 ②常温下铝制容器可储运浓硫酸或浓硝酸
③盐酸既有氧化性又有还原性 ④ Fe(OH)3、FeCl2、H2SiO3都不能直接用化合反应制备
⑤ SO2能使酸性高锰酸钾溶液褪色,所以它具有漂白性
| A.②③ | B.①②③ | C.①②③④ | D.①②③⑤ |