在反应5NH4NO3=2HNO3+4N2↑+9H2O中,发生氧化反应和发生还原反应的氮原子个数比是
| A.5:8 | B.3:5 | C.5:4 | D.5:3 |
aX(g)+bY(g) cZ(g)+dW(g)在一定体积的密闭容器中反应5 min达到平衡时,X减少n mol·L-1,Y减少
cZ(g)+dW(g)在一定体积的密闭容器中反应5 min达到平衡时,X减少n mol·L-1,Y减少 mol·L-1,Z增加
mol·L-1,Z增加 mol·L-1。若将体系压强增大,W的百分含量不发生变化。则化学方程式中各物质的化学计量数之比a∶b∶c∶d应为
mol·L-1。若将体系压强增大,W的百分含量不发生变化。则化学方程式中各物质的化学计量数之比a∶b∶c∶d应为
| A.3∶1∶2∶1 | B.1∶3∶2∶2 |
| C.3∶1∶2∶2 | D.1∶3∶1∶2 |
两种气态烃组成的混合气体完全燃烧后得到CO2和H2O的物质的量随混合烃的总物质的量的变化如图所示,则下列对混合烃的判断正确的是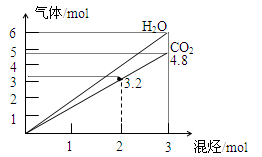
①一定有乙烯;②一定有甲烷;③一定有丙烷;
④一定无乙烷;⑤可能有乙烷;⑥可能有丙炔。
| A.②③⑤ | B.⑤⑥ | C.②④⑥ | D.①④ |
乙醇分子结构中各种化学键如图所示,工业上可用乙烯水化法制乙醇,下列关于对乙烯和乙醇的有关说法不正确的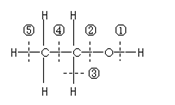
| A.乙烯分子为平面结构 |
| B.乙烯可用作植物生长的调节剂 |
| C.乙醇在铜催化下和氧气反应键①和③断裂 |
| D.乙醇和乙酸、浓硫酸共热时键②断裂 |
一定温度,可逆反应2NO2 2NO+O2在体积固定的密闭容器中反应,达到平衡状态标志是
2NO+O2在体积固定的密闭容器中反应,达到平衡状态标志是
①单位时间内生成n mol O2 ,同时生成2n mol NO2
②单位时间内生成n mol O2 ,同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2 :2 :1
④混合气体的压强不再改变
⑤混合气体的颜色不再改变
⑥混合气体的平均摩尔质量不再改变
| A.①④⑤⑥ | B.①②③⑤ | C.②③④⑥ | D.以上全部 |
锌电池有望代替铅蓄电池,它的构成材料是锌、空气、某种电解质溶液,发生的总反应式是2Zn+O2==2ZnO。下列有关它的说法正确的是
| A.锌为电池负极,发生氧化反应 |
| B.电解质溶液是酸性溶液 |
| C.电池工作时,氧气与锌直接化合,生成氧化锌 |
| D.负极发生的反应是:Zn-2e-+H2O=ZnO+2H+ |