Rm+与Xn-具有相同的电子层结构,则两种微粒半径大小关系为( )
| A.前者大于后者 | B.前者小于后者 | C.前者等于后者 | D.不能确定 |
一种试剂能把乙醇、乙酸、甲酸、丙醛溶液区别开,这种试剂是
| A.新制Cu(OH)2悬浊液 | B.溴水 |
| C.银氨溶液 | D.KMnO4酸性溶液 |
设NA为阿伏加德罗常数的值,下列有关叙述不正确的是
| A.标准状况下,1L乙烷所含有的分子数为NA/22.4 |
| B.1mol甲基(—CH3)所含电子数为9NA |
| C.常温下,28g C2H4含NA个碳碳双键 |
| D.1L0.1mol•L﹣1乙酸溶液中H+数为0.1NA |
分子式为C3H6Cl2的同分异构体共有(不考虑立体异构)
| A.2种 | B.3种 | C.4种 | D.5种 |
同温同压下,某有机物和过量Na反应得到V1 L氢气,取另一份等量的有机物和足量NaHCO3反应得V2 L二氧化碳,若V1=V2 ≠ 0,则该有机物可能是
| A.HOCH2CH2OH | B.HOOC—COOH |
C. |
D.CH3COOH |
有4种碳骨架如下的烃,下列说法正确的是
a.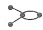 b.
b.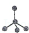 c.
c.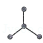 d.
d.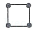
①a和d是同分异构体②b和c是同系物③a和d都能发生加成反应 ④只有b和c能发生取代反应.
| A.①④ | B.①②③ | C.②③ | D.①② |