某元素的一价阴离子,核外有10个电子,质量数为19,则中子数为( )
| A.9 | B.10 | C.11 | D.12 |
白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P a kJ/mol、P—O b kJ/mol、P="O" c kJ/mol、O=O d kJ/mol。根据图示的分子结构和有关数据估算该反应的ΔH,其中正确的是
| A.(6a+5d-4c-12b)kJ/mol | B.(4c+12b-6a-5d)kJ/mol |
| C.(4c+12b-4a-5d)kJ/mol | D.(4a+5d-4c-12b)kJ/mol |
设反应C+CO2 2CO(正反应吸热)反应速率为v1,N2+3H2
2CO(正反应吸热)反应速率为v1,N2+3H2 2NH3(正反应放热),反应速率为v2。对于上述反应,当温度升高时,v1、v2的变化情况为
2NH3(正反应放热),反应速率为v2。对于上述反应,当温度升高时,v1、v2的变化情况为
| A.同时增大 | B.同时减小 |
| C.v1增大,v2减小 | D.v1减小,v2增大 |
Na2S2O3溶液跟稀H2SO4反应的化学方程式为: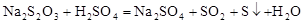 。下列各组实验中,溶液中最先变浑浊的是
。下列各组实验中,溶液中最先变浑浊的是
| 反应 |
反应物 |
H2O |
||||
| 温度 |
Na2S2O3 |
H2SO4 |
V |
|||
| ℃ |
v(mL) |
c(mol×L-1) |
v(mL) |
c(mol×L-1) |
(mL) |
|
| A |
10 |
5 |
0.1 |
10 |
0.1 |
5] |
| B |
10 |
5 |
0.1 |
5 |
0.1 |
10 |
| C |
30 |
5 |
0.1 |
5 |
0.1 |
10 |
能提高单位体积内活化分子数,但不改变活化分子百分数的是
| A.增大反应物的浓度 | B.增大气体压强 |
| C.升温 | D.使用催化剂 |
强酸与强碱稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)===H2O(l)ΔH=-57.3 kJ·mol-1。向1 L 0.5 mol·L-1的NaOH溶液中加入下列物质:①浓硫酸 ②稀硝酸,恰好完全反应的热效应依次为ΔH1、ΔH2,则二者的关系正确的是
| A.ΔH1=ΔH2 | B.ΔH1>ΔH2 |
| C.ΔH2>ΔH1 | D.无法比较 |