右图中X为电源,Y为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,通电后Y中央的紫红色色斑向d端扩散。下列判断正确的是()
| A.烧杯中溶液中SO42-向Cu电极定向移动 |
| B.Cu电极质量减小,Pt电极质量增大 |
| C.烧杯中溶液的pH先减小,后增大 |
| D.滤纸上c点附近会变红色 |
已知苯酚钠溶液中通入二氧化碳,充分反应后只能生成苯酚和碳酸氢钠;而偏铝酸钠溶液中通入二氧化碳时,可生成氢氧化铝和碳酸钠,则下列说法正确的是
| A.酸性:苯酚<氢氧化铝<碳酸 |
B.结合质子的能力:  <HCO3-<CO32-<AlO2- <HCO3-<CO32-<AlO2- |
| C.同温、同浓度下溶液碱性强弱:偏铝酸钠>碳酸钠>苯酚钠>碳酸氢钠 |
| D.相同pH的下列溶液其物质的量浓度:碳酸氢钠>碳酸钠>苯酚钠 >偏铝酸钠 |
一种气态烷烃和一种气态烯烃组成的混合气体共10g,其密度是相同条件下H2的12.5倍,该混合气通过Br2水时,Br2水增重8.4g,则组成该混合气的可能是
| A.甲烷、乙烯 | B.乙烷、乙烯 | C.乙烷、丙烯 | D.甲烷、丙烯 |
常温下将两个铂电极插入200mLCuSO4溶液中进行电解,通电一定时间后,某一电极增重0.064g (设电解时该电极无氢气析出,且不考虑水解和溶液体积变化)。此时溶液中的pH为
| A.2 | B.3-lg2 | C.3 | D.3+lg2 |
新鲜水果、蔬菜、乳制品中富含的维生素C具有明显的抗衰老作用,但易被空气氧化。某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式为: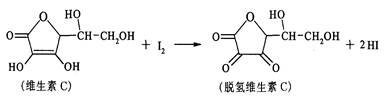
下列说法正确的是
| A.上述反应为取代反应 | B.滴定时可用酚酞溶液作指示剂 |
| C.滴定时应剧烈振荡锥形瓶 | D.脱氢维生素C的分子式为C6H6O6 |