关于元素周期表和元素周期律的应用有如下叙述:①元素周期表是同学们学习化学知识的一种重要工具;②利用元素周期表可以预测新元素的原子结构和性质;③利用元素周期表和元素周期律可以预言新元素;④利用元素周期表可以指导寻找某些特殊的材料。其中正确的是( )
| A.①②③④ | B.只有②③④ | C.只有③④ | D.只有②③ |
一定温度下,难溶强电解质的饱和溶液中存在着沉淀溶解平衡,其平衡常数为
| 物质 |
Fe(OH)2 |
Cu(OH)2 |
Fe(OH)3 |
| Ksp(25℃) |
8.0×10﹣16 |
2.2×10﹣20 |
4.0×10﹣38 |
对于含Fe2(SO4)3、FeSO4和CuSO4各0.5mol的混合溶液1L,根据上表数据判断,说法错误的是
A.向混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀
B.向溶液中加入双氧水,并用CuO粉末调节pH,过滤后可获较纯净的CuSO4溶液
C.该溶液中c(SO42﹣):[c(Fe3+)+c(Fe2+)+c(Cu2+)]=5:4
D.将少量FeCl3粉末加入含Cu(OH)2的悬浊液中,其中c(Cu2+)增大
X、Y、Z、W四种短周期元素在元素周期表中的相对位置如图所示,这四种元素原子的最外层电子数之和为20,下列判断正确的是
| W |
X |
Y |
| Z |
A. 四种元素的原子半径:rZ>rX>rY>rW
B. 四种元素形成的单质最多有6种
C. 四种元素均可与氢元素形成电子总数为18的分子
D. 四种元素中,Z的最高价氧化物对应的水化物酸性最强
如图所示是298 K时,N2与H2反应过程中能量变化的曲线图,下列叙述错误的是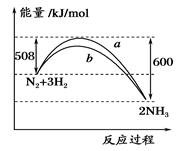
| A.加入催化剂,不能改变该化学反应的反应热 |
| B.b曲线是加入催化剂时的能量变化曲线 |
| C.该反应的热化学方程式为:N2(g)+3H2(g)⇌2NH3(g),ΔH=-92 kJ/mol |
| D.在温度、体积一定的条件下,通入1 mol N2和3 molH2反应后放出的热量为92kJ |
下列化合物中与自身类别相同的同分异构体数目(不考虑立体异构)最多的是
| A.戊烷 | B.戊醇 |
| C.戊烯 | D.乙酸丙酯 |
化学与社会、生活密切相关。对下列现象或事实解释错误的是
| 选项 |
现象或事实 |
解释 |
| A |
明矾用于净水 |
铝离子水解产生的胶体具有很强吸附杂质的作用 |
| B |
SO2能使品红溶液褪色 |
SO2具有漂白性 |
| C |
“地沟油”禁止食用,但可以用来制肥皂 |
“地沟油”主要成分为油脂属于酯类可以发生皂化反应 |
| D |
用氯水和淀粉溶液鉴别食盐是否加碘 |
目前加碘食盐中含碘元素物质为KI |