用下图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U型管的质量差,实验测得m(H)∶m(O)>1∶8。下列对导致这一结果的原因的分析中,一定错误的是:
| A.Ⅰ、Ⅱ装置之间缺少干燥装置 | B.Ⅲ装置后缺少干燥装置 |
| C.Ⅱ装置中玻璃管内有水冷凝 | D.CuO没有全部被还原 |
取镁条的灰黑色“外衣”进行实验:
实验1:取样,加过量盐酸全部溶解为无色溶液,并产生能使澄清石灰水变浑浊的气体
实验2:取样,加热,试管壁有水珠生成,所得气体也能使澄清石灰水变浑浊
则下列说法正确的是 ( )
| A.该样品可能是Mg2(OH)2CO3 |
| B.该样品一定是MgCO3 |
| C.该样品可能是氧化镁的水化物(MgO·H2O) |
| D.该样品中一定含有单质碳 |
镁在焰火、闪光粉、鞭炮中是不可缺少的原料,工业制造镁粉是将镁蒸气在某气体中冷却,下列可作为冷却镁蒸气的气体的是 ( )
①空气 ②CO2 ③Ar ④H2 ⑤N2
| A.①② | B.②③ | C.③④ | D.④⑤ |
某同学通过下列实验探究Mg及其化合物的性质,操作正确且能达到目的的是 ( )
| A.将水加入浓硫酸中得到稀硫酸,置镁条于其中探究Mg的活泼性 |
| B.将NaOH溶液缓慢滴入MgSO4溶液中,观察Mg(OH)2沉淀的生成 |
| C.将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀 |
| D.镁必须密封保存在容器中,防止镁跟空气中的氧气反应 |
海水中含有氯化镁,是镁的重要来源之一。下列从海水中提取镁涉及的化学方程式中,不正确的是 ( )
| A.制石灰乳:CaO+H2O====Ca(OH)2 |
| B.制Mg(OH)2:MgCl2+Ca(OH)2====Mg(OH)2↓+CaCl2 |
| C.制MgCl2:Mg(OH)2+2HCl====MgCl2+2H2O |
| D.制Mg,在MgCl2溶液中加Na:MgCl2+2Na====2NaCl+Mg |
某溶液中含有Al3+、Cu2+、Na+、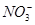 、
、 、Cl-,其中c(Al3+)=0.5 mol·L-1,c(Cl-)=0.8 mol·L-1,c(Na+)="1" mol·L-1,c(Cu2+)=
、Cl-,其中c(Al3+)=0.5 mol·L-1,c(Cl-)=0.8 mol·L-1,c(Na+)="1" mol·L-1,c(Cu2+)=
0.25 mol·L-1,c(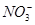 )=1.2 mol·L-1,则c(
)=1.2 mol·L-1,则c( )为 ( )
)为 ( )
| A.0.5 mol·L-1 | B.0.8 mol·L-1 |
| C.1 mol·L-1 | D.无法计算 |