将铝粉和某铁的氧化物FeO·2Fe2O3粉末配制成铝热剂,分成两等分。一份直接放入足量的烧碱溶液中,充分反应后放出气体在标准状况下的体积为15.68L,另一份在高温下恰好反应完全,反应后的混合物与足量的盐酸反应后,放出的气体在标准状况下的体积为:
| A.11.20L | B.15.68L | C.22.40L | D.31.36L |
锂碘电池的正极材料是聚2-乙烯吡啶(简写为P2VP)和I2的复合物,正极的电极反应式为P2VP·nI2+2Li++2e-=P2VP·(n-1)I2+2LiI,电解质是固态薄膜状碘化锂。下列说法正确的是
| A.P2VP和I2的复合物是绝缘体,不能导电 |
| B.电池工作时,碘离子移向P2VP和I2的复合物 |
| C.电池的总反应为2Li+P2VP·nI2=P2VP·(n-1)I2+2LiI |
| D.若该电池所产生的电压较高,则该电池使用寿命比较长 |
水热法制备Fe3O4纳米颗粒的反应为3Fe2++2S2O32-+O2+xOH-=Fe3O4+S4O62-+2H2O。下列说法中正确的是
| A.3mol Fe2+被氧化时有1molO2被还原 |
| B.该反应中只有Fe2+是还原剂 |
| C.每生成1mol Fe3O4转移2mol电子 |
| D.反应方程式中化学计量数x=2 |
将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为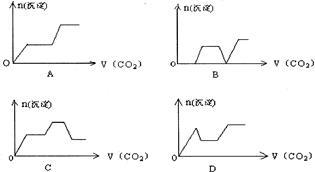
根据碘与氢气反应的热化学方程式:
①I2(?)+H2(g) 2HI(g) ΔH="-9.48" kJ·mol-1
2HI(g) ΔH="-9.48" kJ·mol-1
②I2(?)+H2(g) 2HI(g) ΔH="+26.48" kJ·mol-1
2HI(g) ΔH="+26.48" kJ·mol-1
下列判断中正确的是
| A.①中的I2为固态,②中的I2为气态 |
| B.254 g I2(g)完全反应放热9.48 kJ |
| C.①的产物比②的产物热稳定性更好 |
| D.1 mol固态碘升华时将吸热17 kJ |
下列叙述正确的是
①任何化学反应都有反应热 ②化合物MgO、SiO2、Al2O3中化学键的类型相同 ③有些化学键断裂时吸收能量,有些化学键断裂时放出能量 ④PH3分子稳定性和沸点均低于NH3分子 ⑤O3和NO2都是共价化合物 ⑥有热量变化的过程一定有化学键的断裂与形成 ⑦单质中不可能有离子键 ⑧有化学键断裂的变化属于化学变化
| A.①④⑦ | B.②③ | C.③⑤ | D.②⑤⑥ |