某学生实验兴趣小组拟用图1装置来完成“NaHCO3和NaCl混合物中NaHCO3含量的测定”的实验。
图1
(1)各仪器接口连接顺序是_________________(用接口字母填写)。
(2)该装置连接好而未装药品前,检验气密性的操作是_________________________。
(3)甲同学认为上述方法误差较大,提出如下改进措施,你认为可行的有______。(填序号)
| A.在滴入盐酸之前,应排净装置内的CO2气体 |
| B.在装置①中稀盐酸换成稀硫酸,装置②中水换成饱和NaHCO3溶液 |
| C.在装置②中水换成饱和Na2CO3溶液 |
| D.滴加盐酸不宜过快 |
(4)乙同学认为在装置②③之间的导管内会积存水,使测定结果不准,从而改用图2装置。假定滴定管起始读数为V1mL,终了读数为V2mL,而注射器测定排出的气体为V3mL(标准状况下),混合物样品质量为m g,则原混合物中NaHCO3的质量分数的表达式为_______。
(用含V1、V2、V3、m的式子表示)。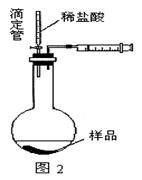
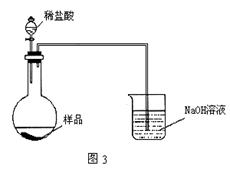
(5)丙同学改用图3装置,通过测定烧杯的质量。你认为乙、丙两同学的方案中,谁的方案更合理__________,理由是:_____________。
下图表示配制 100 mL 0.100 mol·L-1 Na2CO3溶液的几个关键实验步骤和操作,据图回答下列问题: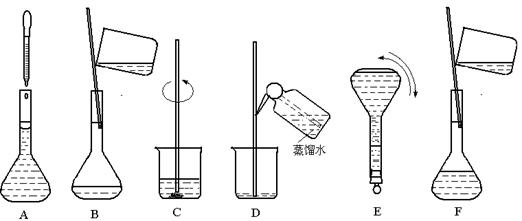
(1)步骤E中将一玻璃仪器上下颠倒数次,该仪器的名称是。
(2)步骤B通常称为转移,步骤A通常称为 。
。
(3)将上述实验步骤A→F按实验过程先后次序排列。
下图是实验室加热氯酸钾和高锰酸钾的混合物制取和收集氧气的装置图
⑴指出图中有标号的仪器名称:
a:_______ b:_______ c:_______ d:_______
⑵实验时应注意:①实验前要检查装置的_______性,其
方法是_______。
②试管口要_______,其目的是_______。
③给试管加热时_______。④停止加热时,先要_______,然后_______。
某强酸性溶液X中含有Ba2+、A l3+、NH4+、Fe2+、Fe3+、CO32—、SO32—、SO42 —、Cl—、NO3—中的一种或几种,取该溶液进行连续实验,实验过程如下:
—、Cl—、NO3—中的一种或几种,取该溶液进行连续实验,实验过程如下:
根据以上信息,回答下列问题:
(1)上述离子中,溶液X中除H+外还一定含有的离子是____________________,不能确定的阳离子是___________,若要用实验证明该离子一定不存在,其最可靠的化学方法是________________________________________________________。
(2)沉淀G的化学式为_____________。
(3)写出下列反应的离子方程式:
①中生成气体A:_______________________________________。
②生成沉淀I:_______________________________________________。
(4)假设测定A、F、I均为0.01mol,10mL X溶液中n(H+)=0.04mol,且不能确定含有的离子只有一种。当X溶液中不能确定离子是_________,沉淀C物质的量___________。
食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含有少量Ca2+、Mg2+、Fe3+、SO42-等杂质离子,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
步骤1:取一定量的粗盐,置于烧杯中,加入足量的水,配成粗盐水;
步骤2:向粗盐水中加入除杂试剂,然后进行过滤,滤去不溶物,再向滤液中加入盐酸调
节盐水的pH;
步骤3:将得到的溶液蒸发浓缩、冷却、结晶、过滤、烘干即得精盐;
请回答以下问题:
①上述实验中的过滤操作需要烧杯、____________、____________等玻璃仪器.
②步骤2中常用Na2CO3、NaOH、BaCl2作为除杂试剂,则加入除杂试剂的顺序为:
、、 NaOH。
③步骤2中,判断加入BaCl2已过量的方法是
________________________。
(2)为检验精盐纯度,需配制100 mL 0.5mol/L(精盐)溶液,右图是该
同学转移溶液的示意图,图中的错误是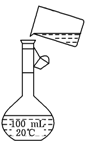
________________________________________________。
若在定容时仰视,则所配溶液的浓度_______0.5mol/L(填>或<)。
(3)电解饱和食盐水的装置如图所示,若收集的H2为2L,
则相同条件下收集的Cl2(填>、=或<)
2L,原因
(4)某学习小组设计了如下图实验,将氯气依次通过下列装
置以验证氯气的性质: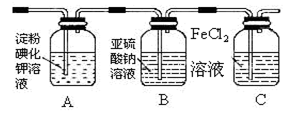

①通入氯气后,A中的现象是,整套实验装置存在的明显缺
陷是 。
②C装置中发生反应的离子方程式为。
③请你帮该小组同学设计一个实验,证明洗气瓶B中的Na2SO3已被氧化(简述实验步骤):
绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。
(1)检验制得的绿矾晶体中是否含有Fe3+的实验操作是。
(2)操作II中,通入硫化氢至饱和的目的是;在溶液中用硫酸酸化至pH=2的目的是。
(3)操作IV的顺序依次为:、冷却结晶、。
(4)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②。
(5)测定绿矾产品中Fe2+含量的方法是:a.称取2.8500g绿矾产品,溶解,在250mL容量瓶中定容;b. 量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.0100
量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.0100 0mol/L
0mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①滴定时发生反应的离子方程式为: 。
②判断此滴定实验达到终点的方法是。
③计算上述样品中FeSO4·7H2O的质量分数为(用小数表示,保留三位小数)。