已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。下列说法正确的是( )
A.元素A、B组成的化合物常温下一定呈气态
B.一定条件下,元素C、D的最高价氧化物对应的水化物之间不能发生反应
C. C、D、E的半径:C>D>E
D.化合物AE与CE具有相同类型的化学键
一种新的酒后驾车人员体内酒精含量的检测装置如右图所示,下列说法不正确的是
| A.该检测装置实现了将化学能转化了电能,且单位时间内通过电量越大,酒精含量越高 |
| B.电极A 的反应: H2O + C2H5OH-4e- = CH3COOH + 4H+ |
| C.电极B 是正极,且反应后该电极区pH 值减小 |
| D.电池总反应:O2 + C2H5OH = CH3COOH + H2O |
1913年德国化学家哈伯发明了以低成本制造大量氨的方法,下列是哈伯法的流程图,其中为提高原料转化率而采取的措施是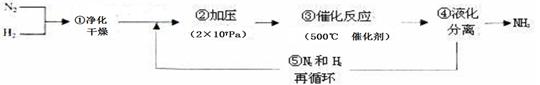
| A.①②③ | B.②④⑤ | C.①③⑤ | D.②③④ |
在密闭容器中发生反应:X+3Y  2Z ΔH < 0,其中Z呈气态,且Z在平衡混合气中的体积分数(Z%)与温度(T)、压强(P)的关系如图。下列判断正确的是
2Z ΔH < 0,其中Z呈气态,且Z在平衡混合气中的体积分数(Z%)与温度(T)、压强(P)的关系如图。下列判断正确的是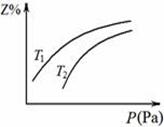
| A.T1大于T2 |
| B.Y一定呈气态 |
| C.升高温度,该反应的化学平衡常数增大 |
| D.当n(X):n(Y):n(Z)=1:3:2时,反应一定达到平衡状态 |
在密闭容器中发生反应:aX(g) + bY(g) cZ(g) + dW(g),反应达到平衡后,保持温度不变,将气体体积压缩到原来的1/2,当再次达到平衡时,W的浓度为原平衡的1.8倍。下列叙述中不正确的是
cZ(g) + dW(g),反应达到平衡后,保持温度不变,将气体体积压缩到原来的1/2,当再次达到平衡时,W的浓度为原平衡的1.8倍。下列叙述中不正确的是
| A.平衡向逆反应方向移动 | B.a + b < c + d |
| C.Z的体积分数增大 | D.X的转化率下降 |
某温度下,反应2CH3OH(g)  CH3OCH3(g) + H2O(g) 的平衡常数为400。此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度为表中相应的数据。下列说法正确的是
CH3OCH3(g) + H2O(g) 的平衡常数为400。此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度为表中相应的数据。下列说法正确的是
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
| 浓度/(mol·L-1) |
0.44 |
0.6 |
0.6 |
A.CH3OH的起始浓度为1.04 mol/L B.平衡时CH3OH的浓度为0.04 mol/L
C.此时逆反应速率大于正反应速率 D.平衡时CH3OH的转化率小于80%