下列事实与氢键有关的是
| A.水加热到很高的温度都难以分解 |
| B.水结冰成体积膨胀,密度减少 |
| C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增加而升高 |
| D.HF、HCI、HBr、HI的热稳定性依次减弱 |
已知在25℃、1.0×105Pa条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是()
| A.H2O(g)==H2(g)+1/2 O2(g) ΔH=+242 kJ·mol-1 |
| B.2H2(g)+O2(g)===2H2O(l) ΔH=-484kJ·mol-1 |
| C.H2(g)+1/2 O2(g)==H2O(g) ΔH=+242kJ·mol-1 |
| D.2H2(g)+O2(g)==2H2O(g) ΔH=+484 kJ·mol-1 |
下图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是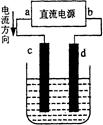
| A.a为负极、b为正极 | B.a为阳极、b为阴极 |
| C.电解过程中,d电极质量增加 | D.电解过程中,氯离子浓度不变 |
下列叙述中能说明金属A肯定比金属B的活泼性强的是 ( )
| A.A原子的最外层电子数比B原子的最外层电子数少 |
| B.A原子电子层数比B原子电子层数多 |
| C.1mol A从酸中置换出的H2比1molB从酸中置换的H2多 |
| D.常温时,A能从稀盐酸中置换出氢,而B不能 |
用铁片与稀硫酸反应制取氢气时,下列措施不能使反应速率加快的是()
| A.不用稀硫酸,改用98%浓硫酸 | B.加热 |
| C.滴加少量CuSO4溶液 | D.不用铁片,改用铁粉 |
下列变化中,吸收的热量用于克服分子间作用力的是()
| A.加热金属铝使之熔化 | B.液氨受热蒸发 |
| C.加热碘化氢气体使之分解 | D.加热硅晶体使之熔化 |