短周期元素X、Y、Z在周期表中位置关系如图:(答题时,X、Y、Z用所对应的元素符号表示)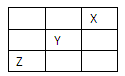
(1)x元素的单质分子式是_______,单质是_______晶体。
(2)自然界中存在一种仅含钙与Y两种元素的天然矿物,其电子式为_______,属于_______晶体。
(3)Z的氢化物和Y的氢化物沸点高低顺序是: ,理由:
。
(4)X、Y、Z三种元素中,电负性最大的是: 。
M、Q、X、Y、Z是前四周期的5种元素,原子序数依次增大,其结构或性质信息如下表:
| 元素 |
结构或性质信息 |
| M |
M的一种单质是自然界最硬的物质 |
| Q |
基态原子最外层未成对电子数在该元素所在周期中最多 |
| Y |
单质常温、常压下是气体。基态原子的M层上有1个未成对的p电子 |
请回答以下问题:
(1)a.学生甲根据M原子易形成4对共用电子的特点,推出M原子应该具有4个未成对电子。画出基态M原子的价层电子排布图为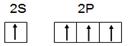 ,请判断对错,并加以解释
,请判断对错,并加以解释
b.M的另一种单质被称为混合型晶体,具有平面层状结构。M原子的杂化方式为________,其晶体中含有的作用力为________________________________________
(2)写出与Q单质分子互为等电子体的常见微粒的化学式(分子、阴离子各1个)、;并写出该阴离子的 电子式___________
电子式___________
(3)a.学生乙通过查表,确定Q与Y的电负性接近。但是Q的氢化物分子间能形成氢键,X的氢化物分子间却不易形成氢键,试从结构的角度加以解释:
b.氢键的形成,对分子的沸点影响较大,请判断以下两种互为同分异构体的分子沸点高低:
邻羟基苯甲酸 ______ 对羟基苯甲酸,原因是_________________________________
c.含氧酸的酸性与非羟基氧的个数有关,则Y的四种常见的不同价态含氧酸的酸性由强到弱排序为:
工业常利用CO来制氢气。已知在25℃时:
C(s,石墨) + 1/2 O2(g) =" CO(g)" △H1= -111kJ/mol
H2(g) + 1/2 O2(g) = H2O(g) △H2= -242kJ/mol
C(s,石墨) + O2(g) = CO2(g) △H3= -394kJ/mol
(1)在25℃时,CO(g) + H2O(g)  CO2(g) + H2(g) △H=_____________。
CO2(g) + H2(g) △H=_____________。
(2)在2L密闭容器中,将2 mol CO与3 mol H2O混合加热到800℃,发生下列反应:CO(g)+H2O(g) CO2(g)+H2(g) K=1.0。则平衡后CO的转化率为_______,平衡混合物中H2的体积分数为_______。
CO2(g)+H2(g) K=1.0。则平衡后CO的转化率为_______,平衡混合物中H2的体积分数为_______。
(3)将(2)中的平衡后的混合气体通入300mL 6mol/L NaOH溶液中,充分吸收,所得溶液中离子浓度由大到小的顺序为____________________________________ _____________。
_____________。
(4)将(3)中剩余的气体通过足量浓硫酸后,再与足量氧气用电火花引燃后通入足量的过氧化钠中,过氧化钠的质量增重______g。
(5)工业上也可以用CO和H2生产甲醇:CO(g) + 2H2 (g) = CH3OH (g),在一定条件下,该反应在一个密闭容器中达到平衡,若维持c(H2)和容器的温度不变,
(g) = CH3OH (g),在一定条件下,该反应在一个密闭容器中达到平衡,若维持c(H2)和容器的温度不变, 增大容器的体积,则平衡_________(填字母)
增大容器的体积,则平衡_________(填字母)
| A.不移动 | B.向正反应方向移动 |
| C.向逆反应方向移动 | D.无法判断移动的方向 |
A、G、J均为非金属单质,工业上利用反应①来冶炼与A同主族元素G单质的粗产品。K为无色液体,D是一种常见金属,溶于某无氧酸中 得到H溶液,该无氧酸的阴离子在同主族元素形成的简单阴离子中还原性最强(除放射性元素)。其物质间转化关系如下图:(部分反应物和生成物略去)
得到H溶液,该无氧酸的阴离子在同主族元素形成的简单阴离子中还原性最强(除放射性元素)。其物质间转化关系如下图:(部分反应物和生成物略去)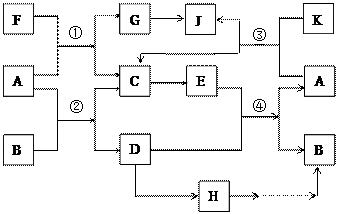
(1)写出下列物质的化学式B______, F_______, H______。A和G的最简单气态氢化物中,较稳定的物质是(填化学式),写出反应①的化学方程式。
(2)反应②是工业上冶炼金属D的方法之一,然而目前世界上60%的D单质是从海水中提取的。以下是海水中提炼金属D的简易流程图(结合工业生产实际,在括号内填写需要加入物质的化学式,方框内填写生成物质的化学式)
(3)海带中含有H的阴离子,常用过氧化氢、稀硫酸和淀粉来检验其阴离子,其主要反应的离子方程式为。
(4)写出G→J的化学方程式________________________________________,某同学利用了某技巧首先配平了G和J的系数,下列关系符合此技巧且正确的是_________
A.反应①:F:G="1:1" B.反应②:A:D=1:1
C.反应③:A:J="2:1" D.反应④:E:B =1:1
已知2A(g)+B(g)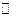 2C(g),△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA和1molB,在500℃时充分反应达平衡后C的浓度为ωmol/L,放出热量为b kJ。
2C(g),△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA和1molB,在500℃时充分反应达平衡后C的浓度为ωmol/L,放出热量为b kJ。
⑴比较a ▲b(填“>”“=”或“<”)。
⑵下表为不同温度下该反应的平衡常数。由此可推知,表中T1 ▲T2(填“>” “=”或“<”)。
| T/K |
T1 |
T2 |
T3 |
| K |
1.00×107 |
2.45×105 |
1.88×103 |
若在原来的容器中,只加入2molC,500℃时充分反应达平衡后,吸收热量为c kJ,C的浓度 ▲(填“>”“=”或“<”)ωmol/L,a、b、c之间满足何种关系 ▲(用代数式表示)。
⑶ 在相同条件下要想得到2a kJ热量,加入各物质的物质的量可能是 ▲。
A. 4molA和2molB B. 4molA、2molB和2molC
C. 4molA和4molB D. 6molA和4molB
⑷为使该反应的反应速率增大,且平衡向正反应方向移动的是 ▲。
A. 及时分离出C气体 B. 适当升高温度
C. 增大B的浓度 D. 选择高效催化剂
⑸ 若将上述容器改为恒压容器(反应前体积相同),起始时加入2molA和1molB,500℃时充分反应达平衡后,放出热量为d kJ,则d ▲b(填“>”“=”或“<”),理由是 ▲。
⑹ 在一定温度下,向一个容积可变的容器中,通入3molA和2molB及固体催化剂,使之反应,平衡时容器内气体压强为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4molA、3molB和2molC,则平衡时A的百分含量 ▲(填“不变”“变大”“变小”或“无法确定”)。
2010年诺贝尔物理学奖被两位英国科学家盖姆和诺沃肖格夫摘得,他们用普通胶带成功地从铅笔芯地石墨中分离出了石墨烯(分子式设为Cx),突破性地创造了撕裂法:他们将石墨分离成小的碎片,从碎片中剥离出较薄的石墨薄片,然后用胶带粘住薄片的两侧,撕开胶带,薄片也随之一分为二,不断重复这一过程,最终得到了截面约100微米的、只有单层碳原子的石墨烯。这种“只有一层碳原子厚的碳薄片”,被公认为目前世界上已知的最薄、最坚硬、传导电子速度最快的新型材料。这种比最好的钢铁还要硬100倍、比钻石坚硬的石墨烯其实就是石墨的二维结构。其超强硬度、韧性和出色的导电性使得制造超级防弹衣、超轻型火箭、超级计算机不再是科学狂想。
⑴下列说法不正确的是 ▲。
A.石墨烯被公认为目前世界上已知的最薄、最坚硬的新型材料,所以他属于原子晶体
B. 石墨烯与金刚石互为同素异性体
C. 若该撕裂法可看做是将石墨结构内层与层间分离开,则此过程中必有共价键被破坏
D. 石墨烯晶体内最小环上有6个原子
E. 石墨烯可看做是芳香烃类的物质
F. 石墨烯晶体在一定条件下可发生加成反应
⑵石墨烯可能具有较强的 ▲(填“氧化性”或“还原性”),因此在足量空气中煅烧可能发生的反应方程式为 ▲。
⑶石墨烯之所以能导电,可认为主要是因为其每个碳原子成键后还有一个单电子,这些单电子均可与最近的3个碳原子中任意一个碳原子形成共价键,也就是说具有该结构的物质一般具有导电性,据此类推下列物质不具有导电性的是 ▲。
A. 石墨 B. 聚乙炔 C. 聚1,3-丁二烯 D. 聚苯乙炔
⑷ 18g石墨烯晶体内含有的碳原子数为 ▲,所含的碳碳单键数为 ▲。