金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)( )
| A.阳极发生还原反应,其电极反应式:Ni2+ + 2e—="=" Ni |
| B.电解过程中,阳极质量的减少与阴极质量的增加相等 |
| C.电解后,溶液中存在的金属阳离子只有Fe2+ 和Zn2+ |
| D.电解后,电解槽底部的阳极泥中只有Cu和Pt |
工业上将氨气和空气的混合气体通过铂铑合金网发生氨氧化反应,若
有标准状况下V L氨气完全反应,并转移n个电子,则阿伏加德罗常数(NA)可表示为( )
设NA为阿伏加德罗常数的值。下列叙述正确的是( )
| A.1 mol甲醇中含有C—H键的数目为4NA |
| B.25 ℃,pH=13的NaOH溶液中含有OH-的数目为 0.1NA |
| C.标准状况下,2.24 L己烷含有分子的数目为0.1NA |
| D.常温常压下,Na2O2与足量H2O反应,共生成0.2 mol O2,转移电子的数目为0.4NA |
设NA是阿伏加德罗常数的数值,下列说法正确的是( )
| A.1 mol Al3+含有的核外电子数为3NA |
| B.1 mol Cl2与足量的铁反应,转移的电子数为3NA |
| C.10 L pH=1的硫酸溶液中含有的H+离子数为2NA |
| D.10 L pH=13的NaOH溶液中含有的OH-离子数为NA |
NA为阿伏加德罗常数,下列叙述错误的是( )
| A.18 g H2O中含有的质子数为10NA |
| B.12 g金刚石中含有的共价键数为4NA |
| C.46 g NO2和N2O4混合气体中含有原子总数为3NA |
| D.1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
某无色溶液中含有K+、Cl-、OH-、SO32—、SO42—,为了检验除OH-外的其他所有阴离子,拟用盐酸、硝酸、硝酸银溶液、氢氧化钡溶液、溴水和酚酞六种试剂,设计如下实验步骤,并记录相关现象。
下列有关结论错误的是( )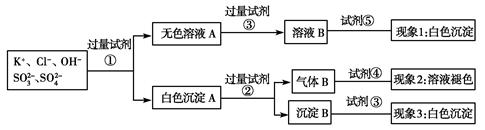
| A.试剂③是AgNO3溶液,试剂⑤是HNO3,现象1中白色沉淀是AgCl |
| B.现象3中白色沉淀是BaSO4 |
| C.产生现象2的离子方程式是Br2+2H2O+SO2=4H++2Br-+SO42— |
| D.试剂②是盐酸,试剂③是硝酸 |