(9分)在一定温度下,向一个容积不变的容器中加入3 mol SO2和2 mol O2及固体催化剂,发生反应:2SO2(g)+O2(g)=2SO3(g)ΔH=-196.6 kJ/mol,平衡时容器内气体压强为起始时的90%。
(1)加入3mol SO2和3mol O2发生反应,达到平衡时,SO2的转化率为_____。
(2)保持温度不变,在相同的容器中,将起始物质的物质的量改为a mol SO2、b mol O2、c mol SO3(g)(c>0),欲使平衡时SO3的体积分数为2/9,O2的体积分数为3/9,则:
①达到平衡时,(1)与(2)放出的热量________(填序号)。
| A.相等 | B.前者小于后者 | C.前者大于后者 | D.无法确定 |
②a.b.c必需满足的关系是(一个用a.c表示,另一个用b.c表示):__ _。
A、B、C为中学常见单质,其中一种为金属;通常情况下,A为固体,B为液体,C
为气体。D、E、F、G、H、X均为化合物,其中X是一种无氧强酸、E为黑色固体,H在常温下为液体。它们之间的转化关系如图所示(其中某些反应条件和部分反应物已略去)。
(1)写出化学式:A________、D________、E________、X________。
(2)在反应①~⑦中,不属于氧化还原反应的是________(填编号)。
(3)反应⑥的离子方程式为:_______________________________________。
(4)反应⑦的化学方程式为_________________________________________;
该反应中每消耗0.3 mol的A,可转移电子______mol。
(5)写出D的溶液与小苏打溶液反应的离子方程式:_________________________
甲、乙为单质,丙、丁为化合物,它们之间存在如下图所示的转化关系。
(1)若甲、乙均为非金属,丙为氧化物,则:
①乙为氧化产物时,乙可能是________(填一种物质的化学式),按照元素周期表推测,此时反应物甲可能是________(填一种物质的化学式);
②乙为还原产物时,丁所属的物质类别是________。
(2)若该转化关系为我国古代湿法冶炼金属乙的原理,写出此反应的化学方程式________。若该转化关系为高温火法冶炼金属乙的原理,且同时生成的丁是一种有刺激性气味的气体,则丙可能为________(填一种物质的化学式)。
将0.1 mol的镁、铝混合物溶于100 mL 2 mol/L H2SO4溶液中,然后再滴加1 mol/L NaOH溶液。请回答:
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如下图所示。当V1=160 mL时,则金属粉末中n(Mg)=________mol,V2=______________mL。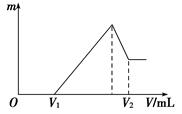
(2)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=____________mL。
(3)若混合物仍为0.1 mol,其中镁粉的物质的量分数为a,用100 mL 2 mol/L的硫酸溶解此混合物后,再加入450 mL 1 mol/L的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是________。
由短周期元素组成的化合物X是某抗酸药的有效成分。甲同学欲探究X的组成。
查阅资料:①由短周期元素组成的抗酸药的有效成分有碳酸氢钠、碳酸镁、氢氧化铝、硅酸镁铝、磷酸铝、碱式碳酸镁铝。
②Al3+在pH=5.0时沉淀完全;Mg2+在pH=8.8时开始沉淀,在pH=11.4时沉淀完全。
实验过程:
Ⅰ.向化合物X粉末中加入过量盐酸,产生气体A,得到无色溶液。
Ⅱ.用铂丝蘸取少量I中所得的溶液,在火焰上灼烧,无黄色火焰。
Ⅲ.向Ⅰ中所得的溶液中滴加氨水,调节pH至5~6,产生白色沉淀B,过滤。
Ⅳ.向沉淀B中加过量NaOH溶液,沉淀全部溶解。
Ⅴ.向Ⅲ中得到的滤液中滴加NaOH溶液,调节pH至12,得到白色沉淀C。
(1)Ⅰ中气体A可使澄清石灰水变浑浊,A的化学式是________。
(2)由Ⅰ、Ⅱ判断X一定不含有的元素是磷、________。
(3)Ⅲ中生成B的离子方程式是________________________________
(4)Ⅳ中B溶解的离子方程式是_________________________________
(5)沉淀C的化学式是_____________________________________________________。
(6)若上述n(A)∶n(B)∶n(C)=1∶1∶3,则X的化学式是______________________
日常生活中使用的铝合金中的铝来自于电解氧化铝。工业上电解氧化铝要求其纯度不得低于98.2%,而天然铝土矿的氧化铝含量为50%~70%,杂质主要为SiO2、Fe2O3、CaO、MgO、Na2O等。工业生产铝锭的工艺流程示意图如下。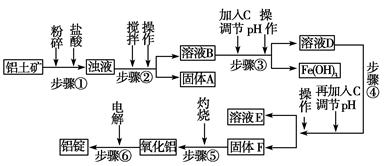
一些氢氧化物沉淀的pH如下表。
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Mg(OH)2 |
| 开始沉淀pH(离子初始浓度0.01 mol/L) |
4 |
2.3 |
10.4 |
| 完全沉淀pH(离子浓度<10-5mol/L) |
5.2 |
4.1 |
12.4 |
请回答下列问题。
(1)实验室进行步骤④的操作名称为________。
(2)固体A的化学式为________,物质C的化学式为________。
(3)步骤④调节pH的范围为________。
(4)步骤⑥反应的化学方程式为________。