有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高,硬度大,是一种重要的半导体材料。下列说法中,正确的是
| A.X、M两种元素只能形成X2M型化合物 |
| B.由于W、Z、M元素的氢化物相对分子质量依次减小,所以其沸点依次降低 |
| C.元素Y、Z、W的单质晶体属于同种类型的晶体 |
| D.元素W和M的某些单质可作为水处理中的消毒剂 |
下列关于化学观或化学研究方法的叙述中,错误的是
| A.在化工生产中应遵循“绿色化学”的思想 |
| B.在过渡元素中寻找优良的催化剂 |
| C.在元素周期表的金属和非金属分界线附近寻找半导体材料 |
D.根据元素周期律,由HClO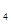 可以类推出氟元素也存在最高价氧化物的水化物HFO 可以类推出氟元素也存在最高价氧化物的水化物HFO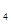 |
下列叙述正确的是
| A.分子晶体中的每个分子内一定含有共价键 |
| B.原子晶体中的相邻原子间只存在非极性共价键 |
| C.离子晶体中可能含有共价键 |
| D.金属晶体的熔点和沸点都很高 |
下列分子中,属于非极性的是
| A.SO2 | B.BeCl2 |
| C.CHCl3 | D.COCl2 |
元素的原子结构决定其性质和周期表中的位置。下列说法正确的是
| A.元素原子的最外层电子数等于元素的最高化合价 |
| B.多电子原子中,在离核较近的区域内运动的电子能量较高 |
| C.P、S、Cl电负性和最高价氧化物对应的水化物的酸性均依次增强 |
| D.元素周期表中位于金属和非金属非界线附近的元素属于过渡元素 |
2011年5月24日,台湾地区有关方面向国家质检总局通报,发现部分饮品中用于分散乳化油脂的食品添加剂“起云剂”中含有禁用物质“塑化剂”。起云剂常见原料是阿拉伯胶、乳化剂、棕榈油或葵花油,祸首台湾昱伸公司制造起云剂时偷梁换柱,用塑化剂取代成本贵5倍的棕榈油以图牟取暴利,与工业酒精勾兑、苏丹红、三聚氰胺事件类同,是极其恶劣的制假行为和严重的食品安全事件。塑化剂中最常见为邻苯二甲酸二(2-乙基己基)酯,简称DOP或DEHP,可用乙醛与邻苯二甲酸酸酐分步合成制得,路线如下图。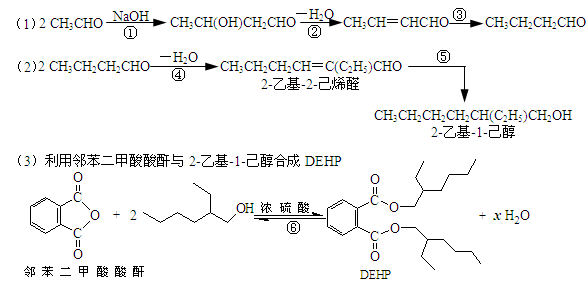
下列说法正确的是
| A.合成过程涉及加成、消去、酯化、聚合等类型的有机反应 |
| B.步骤(1)中②反应发生的条件是在NaOH/醇溶液中加热,反应类型是消去反应 |
| C.步骤(1)(2)连续操作时,③、⑤消耗H2物质的量相等 |
| D.⑥反应方程式中产物H2O系数x=2,及时除去⑥中反应釜内的水可提高DEHP产率 |