实验中的下列操作正确的是
| A.用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,把过量的试剂倒入试剂瓶中 |
| B.用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |
| C.用蒸发方法使NaCl从溶液中析出,应将蒸发皿中NaCl溶液全部蒸干才停止加热 |
| D.分液操作时,分液漏斗中下层液体从下口放出,上层液体也从下口放出 |
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g) + H2O(g)=CO2(g)+3H2(g)△H=+49.0 kJ·mol-1
②CH3OH(g)+ 1/2O2(g)=CO2(g)+2H2(g) △H=-192.9 kJ·mol-1
根据上述反应,下列说法正确的是
A.反应①中的能量变化如右图所示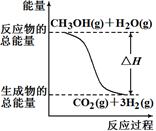 |
| B.CH3OH转变成H2的过程一定要吸收能量 |
| C.1 mol CH3OH充分燃烧放出的热量为192.9 kJ |
| D.可推知2H2(g)+O2(g)=2H2O(g)△H =-483.8 kJ·mol-1 |
下列各组离子在指定的溶液中一定能大量共存的是
| A.含有Fe3+的溶液: |
Na+、SCN-、Cl-、I- |
| B.含有大量NO3-的溶液: |
H+、Fe2+、Cl-、SO42- |
| C.常温下,pH=12的溶液: |
K+、Cl-、SO32-、AlO2- |
| D.c(H+)=0.1 mol·L-1的溶液: |
Na+、NH4+、SO42-、S2O32- |
25℃时,在0.01mol/L的氢氧化钡溶液中,由水电离出的c(OH-)浓度是
| A.0.02mol/L | B.5×10-13mol/L | C.1×10-7mol/L | D.1×10-12mol/L |
反应A+B→C(△H<0)分两步进行:①A+B→X(△H>0),②X→C(△H<0)。下列示意图中,能正确表示总反应过程中能量变化的是
A.B.C.D.
下列化学用语的表述对应正确的是
| A.碳酸氢钠的电离方程式:NaHCO3===Na++H++CO32- |
B.用铜做阳极电解氯化铜溶液的离子方程式:Cu2++2Cl- Cu+Cl2↑ Cu+Cl2↑ |
C.硫化钠水解的离子方程式:S2-+2H2O H2S+2OH- H2S+2OH- |
D.碳酸钙的溶解平衡:CaCO3(s)  Ca2+(aq) + CO32-(aq) Ca2+(aq) + CO32-(aq) |