在一定温度下,可逆反应:A2(气)+B2(气)  2AB(气),达到平衡的标志是
2AB(气),达到平衡的标志是
| A.容器的总压强不随时间而变化 |
| B.单位时间内有nmol A2生成的同时有nmol B2生成 |
| C.单位时间内有nmol B2发生反应的同时有nmol AB分解 |
| D.单位时间内生成nmol A2同时就有2nmol AB生成 |
盐酸与铝粉反应时,下列措施能使最初的反应速率明显加快的是
| A.加入少量NaCl固体 | B.盐酸的用量增加一倍 |
C.盐酸 的用量减半,浓度加倍 的用量减半,浓度加倍 |
D.向反应混合物中加入少许铜粉 |
下列叙述中不正确的是
| A.任一主族元素均由非金属元素和金属元素组成 |
| B.第n周期第n主族的元素可能是金属元素,也可能是非金属元素 |
| C.第n周期有(8-n)种非金属元素(1<n≤7,包括稀有气体) |
| D.同种元素的不同粒子,它们的电子层数可能不同 |
已知反应X+Y= M+N为吸热反应,对这个反应的下列说法中正确的是
A.X 的能量一定低于M的,Y的能量一定低于N的 的能量一定低于M的,Y的能量一定低于N的 |
| B.因为该反应为吸热反应,故一定要加热反应才能进行 |
| C.破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量 |
| D.X和Y的总能量一定低于M和N的总能量 |
有A、B、C、D四块金属片,进行如下实验,①A、B用导线相连后,同时插入稀H2S O4中,A极为负极②C、D用导线相连后,同时浸入稀H2SO4中,电子由C→导线→D③A、C相连后,同时浸入稀H2SO4,C极产生大量气泡④B、D相连后,同时浸入稀H2SO4中,D极发生氧化反应,则四种金属的活动性顺序为:
O4中,A极为负极②C、D用导线相连后,同时浸入稀H2SO4中,电子由C→导线→D③A、C相连后,同时浸入稀H2SO4,C极产生大量气泡④B、D相连后,同时浸入稀H2SO4中,D极发生氧化反应,则四种金属的活动性顺序为:
A.A>B>C>D B.C>A>B>D
C.A>C>D>B D.B>D>C>A
对可逆反应4NH3(g)+5O2(g) 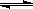 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
| A.达到化学平衡时,4v正(O2)=5v逆(NO) |
B.若单位时间内生成xmolNO的同时,消耗 xmolNH3,则反应达到平衡状态 xmolNH3,则反应达到平衡状态 |
| C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 |
| D.化学反应速率关系是2v正(NH3)=3v正(H2O) |