[化学——选修有机化学基础]
Ⅰ.请选出下列各题中符合题意的选项:
(1)下列不可能存在的有机物是
A.2—甲基丙烷 B.2,3—二氯—2,2—二甲基戊烷
C.3—溴—3—乙基戊烷 D.2,2,3,3—四甲基丁烷
(2)能在KOH的醇溶液中发生消去反应的是 
(3)某有机物既能发生氧化反应,又能发生还原反应,且氧化产物和还原产物能发生酯化反应,所生成的酯也能发生银镜反应。则该有机物的结构简式是
A.CH3OH B.HCHO
C.HCOOH D.HCOOCH3
Ⅱ.有机物A的结构简式为:
据此回答下列问题:
(1)A的分子式为__________。
(2)A在NaOH水溶液中加热,经酸化得到有机物B和D,D是芳香族化合物。当有1 mol A发生反应时,最多消耗 mol NaOH。
(3)B在一定条件下发生酯化反应可生成某五元环酯,该五元环酯的结构简式为 。
(4)写出苯环上只有一个取代基且属于酯类的D的所有同分异构体的结构简式: 。
反应3Fe(S)+4H 2O==Fe3O4(s)+4H2(g),在
2O==Fe3O4(s)+4H2(g),在 一可变的容积的密闭容器中进行,试回答:
一可变的容积的密闭容器中进行,试回答:
①增加Fe的量,其正反应速率的变化是(填增大、不变、减 小,以下相同)
小,以下相同)
②将容器的体 积缩小一半,其正反应速率,逆反应速率
积缩小一半,其正反应速率,逆反应速率 。
。
③保持体积不变,充入N2使体系压强增大,其正反应速率,逆反应速率。
④保持压强不变,充入N2使容器的体积增大,其正反应速率,逆反应速率。
目前世界上比较先进的电解制碱技术是离子交换法,如图为离子交换膜法电解饱和食盐水的原理示意图。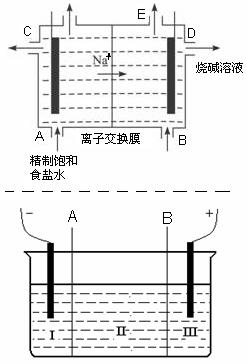
(1)下列说法不正确的是
| A.从E口逸出的气体是H2 |
| B.从B口加入含少量NaOH的水溶液以增强导电性 |
| C.标准状况下每生成22.4 L Cl2,便产生2 mol NaOH |
| D.粗盐水中含Ca2+、Mg2+、Fe3+、SO42-等离子,精制时先加 Na2CO3溶液 |
(2)现有离子交换膜A和B将电解槽分为I、II、III三个区域(下图所示),在这种电解池中电解Na2SO4溶液可 制得氢氧化钠、硫酸等物质。A为离子交换膜、B为离子交换膜(填“阴”或“阳”),电极均为惰性电极。Na2SO4溶液应该在区(填“I”、“II”、“III”)加入。通电电解时阴极的电极反应式为
制得氢氧化钠、硫酸等物质。A为离子交换膜、B为离子交换膜(填“阴”或“阳”),电极均为惰性电极。Na2SO4溶液应该在区(填“I”、“II”、“III”)加入。通电电解时阴极的电极反应式为 ,在III区得到。当外电路总共通过30 mol电子时,生成的NaOH 960克,则电解过程中能量的转化率为:
,在III区得到。当外电路总共通过30 mol电子时,生成的NaOH 960克,则电解过程中能量的转化率为:
Ⅰ、A物质的化学式为M(OH)2,将其溶于水制成稀溶液,该溶液呈中性,在溶液中存在:
M2+ + 2OH-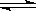 M(OH)2
M(OH)2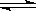 2H+ + MO22-
2H+ + MO22-
回答以下题目一律用“增大”“减小”“不变 ”填空
”填空
(1)在其他条件不变的情况下,25Co时,在蒸馏水中加入A物质后,与加入前比较,
①由水电离出的C(OH-),C(H+),水的电离度,Kw
(2)25Co时,向A的稀溶液中加入少量的烧碱固体。
则水的电离度,溶液的pH
Ⅱ、.室温下,甲、乙两瓶氨水的浓度分别为1mol/L和0.1mol/L,则甲、乙两瓶氨水中C(OH-)之比为10 (填大于、等于或小于)
(15分)
合成氨对化学工业和国防工业具有重要意义。
(1)向合成塔中按1:4的物质的量之比充入N2、H2进行氨的合成,图A为T0C时平衡混合物中氨气的体积分数与压强(P)的关系图。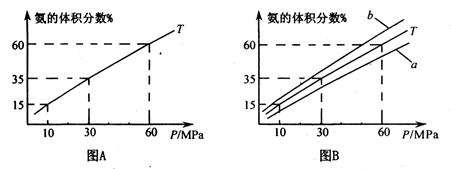
①写出工业上合成氨的化学方程式_____________________。
②图A中氨气的体积分数为15.00%时,H2的转化率="_______" 。
③图B中T=5000C,温度为4500C对应的曲线是_______(选填字母“a"或“b ”),选择的理由是______________
④由图像知,增大压强可提高原料的利用率,从生产实际考虑增大压强需解决的问题是_______(写出一条即可)。
(2)合成氨 所需的氢气可由甲烷与水反应制得,反应的热化学方程式为:
所需的氢气可由甲烷与水反应制得,反应的热化学方程式为: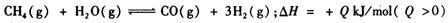
(3)一定温度下,在2 L容器中发生上述反应,各 物质的物质的量变化如下表
物质的物质的量变化如下表
| 时间/min |
CH4(mol) |
H20( mol) |
CO (mol) |
H2 (mol) |
| 0 |
0.40 |
1.00 |
0 |
0 |
| 5 |
X1 |
X2 |
X3 |
0.60 |
| 7 |
Y1 |
Y2 |
0.20 |
Y3 |
| 10 |
0.21 |
0.81 |
0.19 |
0.62 |
①分析表中数据,判断5〜7min之间反应是否处于平衡状态____________(填“是”或“否”),
前5 min平均反应速率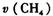 =______。
=______。
②反应在7~ 10 min之间,CO的物质的量减少的原因可能是______(填字母)。
a•减少CH4 b•降低温度 c•增大压强 d•充入H 2
2
③若保持温度不变,向1L容器中起始充入0.15 mol CH4.0.45 mol H2O. ______mol CO、______mol H2 ,达到平衡时CH4的体积百分含量与第一次投料相同。
一定条件下,物质A~E转化关系如图,其中A为单质,常温下E为无色液体。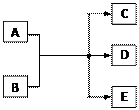
(1)若A、C、D均含氯元素,C为氯碱工业的原料,
D溶液具有漂白性,则A与B反应的化学方程式是;D溶液可使KI淀粉溶液显蓝色,则D与KI在溶液中反应的离子方程式是;过量B溶液与NH4HCO3溶液共热,生成气体G的离子方程式是,G遇硝酸蒸气的现象是。
(2)若A为红色金属,B为某酸的浓溶液,D可形成酸雨的无色气体。A与B反应的化学是;a molA与足量的B充分反应后,将产生的D通入NaOH溶液中,恰好完全反应,则所需NaOH的物质的量的范围是。
(3)上述(1)、(2)中的D都能使品红溶液褪色,利用褪色后的溶液,探究使品红溶液褪色的物质的实验方法是。